
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
分析 ①碱性氧化物是和酸反应生成盐和水的氧化物;
②稀有气体分子中无化学键;
③原子晶体熔点不一定比金属晶体高如金属钨,分子晶体熔点不一定比金属晶体低,如分子晶体硫,金属汞是液体;
④依据过氧化氢和液氮的分子结构分析判断;
⑤氢化物沸点高低是和分子间作用力有关,与化学键无关;
⑥依据非电解质概念分析判断.
解答 解:①碱性氧化物是和酸反应生成盐和水的氧化物,能与酸反应的氧化物,不一定是碱性氧化物,如两性氧化物Al2O3,故①错误;
②稀有气体分子形成分子晶体,晶体中无化学键,故②错误;
③原子晶体熔点不一定比金属晶体高如金属钨熔点3000°C以上,分子晶体熔点不一定比金属晶体低,如分子晶体硫是固体,金属汞是液体,故③正确;
④过氧化氢含有氧氧非极性键,液氮的分子中含有氮氮非极性键,所以都有非极性共价键,故④正确;
⑤氢化物沸点高低是和分子间作用力有关,与化学键无关,故⑤错误;
⑥在熔化状态和水溶液中均不能导电的化合物称为非电解质,故⑥错误;
故选C.
点评 本题考查化学反应及化学键,为高频考点,把握化学键判断的一般规律分析化学键的断裂和形成为解答的关键,注重分析能力和基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
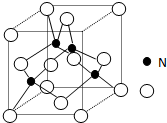 某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于陶瓷工业等领域查看答案和解析>>
科目:高中化学 来源: 题型:解答题
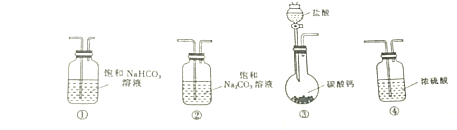
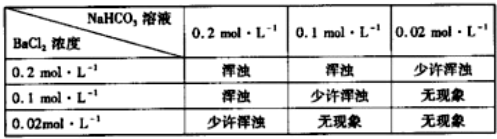

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②不对 | B. | ③不对 | C. | ①不对 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
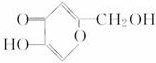 ,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-.
,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-.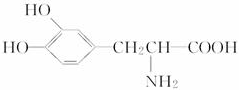 .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
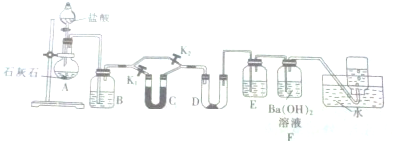
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
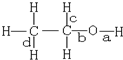
| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和氢溴酸反应键a断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和浓硫酸共热至170℃时键b和d断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com