
| A、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| C、c(Na+)=c(HCO3-)>c(OH-)>c(H+) |
| D、c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |


科目:高中化学 来源: 题型:
| A、C2H4通入溴水中,溴水褪色 |
| B、C2H4通入KMnO4酸性溶液中,溶液褪色 |
| C、苯与溴水混合后振荡,水层褪色 |
| D、CH4与Cl2的混合气体光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、c(H+)=
| ||
| B、将水加热,KW增大,pH不变,仍呈中性 | ||
| C、向水中加入少量硫酸氢钠固体,溶液的c(H+) 增大,平衡逆向移动,KW减小 | ||
| D、向0.1 mol?L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO、N2、NO2、O2的体积比为1:2:3:3 |
| B、N2、NO2、O2的体积比为2:3:2 |
| C、NO、NO2、O2的体积比为4:3:1 |
| D、N2、NO2、O2的体积比为4:8:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
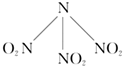 科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )| A、分子中的化学键有极性键和非极性键 |
| B、分子中四个氮原子位于正四面体的顶点 |
| C、该物质的熔、沸点可能比NH3高 |
| D、15.2g该物质含有6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得溶液中溶质的物质的量浓度为1.0mol?L-1 |
| B、剩余气体中氮元素与氧元素的质量为8:7 |
| C、原混合气体中NO2和NO的体积比为1:1 |
| D、反应过程中转移的电子总数为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同浓度的Na2CO3、NaNO3、Na2SO3溶液的导电能力相同 |
| D、CO2、NO2、SO2都能与H2O反应生成电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com