
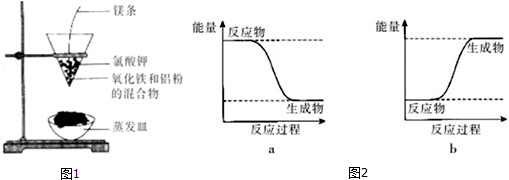
分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2)、少数置换反应(如C和H2O)、某些复分解(如铵盐和强碱)和碳、一氧化碳、氢气等还原金属氧化物.
(2)反应剧烈,火星四射,漏斗下方有红热熔融物流出,说明该反应为放热反应,反应物总能量大于生成物总能量.
解答 解:(1)a.燃烧CO放出热量,属于放热反应,故a不选;
b.Ba(OH)2•8H2O晶体和NH4Cl晶体反应是铵盐与碱反应,属于吸热反应,故b选;
c.铝和稀盐酸反应放出热量,属于放热反应,故c不选;
d.NaOH溶液和稀盐酸反应是酸碱中和反应,属于放热反应,故d不选;
故选b;
(2)反应剧烈,火星四射,漏斗下方有红热熔融物流出,说明该反应为放热反应,方程式为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示;
故答案为:放热;Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2 Fe;a.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 含1mol溶质的任何溶液,物质的量浓度一定相等 | |
| B. | 体积相同,物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 | |
| C. | 1L0.5mol•L-1CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5mol•L-1 | |
| D. | 从1L0.2mol•LNaOH溶液中取出100ml,这100ml溶液的物质的量浓度是0.02mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 化学方程式为 NO2(g)+CO(g)?CO2(g)+NO(g) | |
| C. | 降温,正反应速率减小 | |
| D. | 恒温时,增大压强颜色加深,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C与Si位于同一主族,且干冰与SiO2都是酸性氧化物,所以二者晶体类型相同 | |
| B. | NaCl和AlCl3均为强电解质,二者在熔融状态下都能导电 | |
| C. | 从晶体类型上来看物质的熔沸点,其规律是:原子晶体>离子晶体>分子晶体 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ | |
| B. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | |
| C. | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com