
分析 (1)为酸与碳酸钡的反应,生成可溶性钡盐;
(2)为铁盐与可溶性碱的反应,生成氢氧化铁.
解答 解:(1)为酸与碳酸钡的反应,如盐酸和碳酸钡反应,生成可溶性钡盐,化学方程式为2HCl+BaCO3═BaCl2+CO2↑+H2O,
故答案为:2HCl+BaCO3═BaCl2+CO2↑+H2O;
(2)为铁盐与可溶性碱的反应,生成氢氧化铁,如氯化铁与氢氧化钠,方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl,
故答案为:FeCl3+3NaOH═Fe(OH)3↓+3NaCl.
点评 本题考查离子方程式的书写,为高频考点,侧重于基本概念的考查,注意把握离子反应的特点以及离子方程式的书写方法,难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mol O3的质量是16g | B. | 32gO2中含有的氧气分子数为2NA | ||
| C. | 1gH2中含有的电子数为NA | D. | 0.5NA个铜原子的质量为64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液与铁粉反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 实验室制二氧化碳:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| C. | 二氧化碳与水反应:CO2+H2O═CO32-+2H+ | |
| D. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
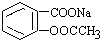 转变为
转变为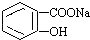 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
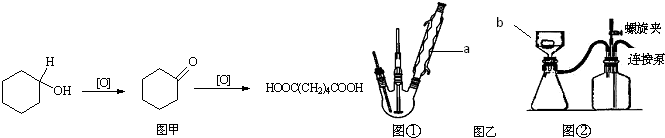
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥③⑤ | B. | ④⑥③⑤ | C. | ④⑥①③ | D. | ②⑥①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com