
 Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)  Mg+Cl2↑;
Mg+Cl2↑;
| ||
 NH3?H2O;②2H++Mg(OH)2=Mg2++2H2O; C;
NH3?H2O;②2H++Mg(OH)2=Mg2++2H2O; C;

科目:高中化学 来源: 题型:
| A、小苏打是弱电解质,其水溶液导电能力很弱 |
| B、氨气是非电解质,但氨水能导电 |
| C、稀释醋酸溶液,可以促进醋酸分子电离使溶液pH减小 |
| D、硫酸是强电解质,在水溶液和熔融状态下均能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成的氢气中只含有D2 |
| B、生成的氢气中只含有H2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.
某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.查看答案和解析>>
科目:高中化学 来源: 题型:
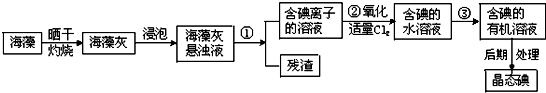

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | SiO2 | 氢氟酸 |
| ② | O2 | N2 | H2 |
| ③ | 双氧水 | SO2 | BaCl2溶液 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com