
 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.分析 【讨论】(1)该化合物中O元素化合价为-2价、Cl元素化合价为-1价,根据化合物中各元素化合价的代数和为0确定S元素化合价;
(2)用高锰酸钾和浓盐酸制氯气,反应中Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合得失电子守恒、原子守恒书写方程式;
【实验探究】Ⅰ.探究反应产物:
(3)SO2Cl2和H2O反应产生白雾,经检验:该无色溶液中的阴离子(除OH-外)只有SO42-、Cl-,说明生成HCl和硫酸,根据反应物和生成物书写方程式;
Ⅱ.探究反应进行的程度.
(4)亚硫酸的酸性小于盐酸,亚硫酸盐和盐酸酸化的氯化钡不反应,硫酸根离子和盐酸酸化的氯化钡反应生成硫酸钡白色沉淀;
【质疑】(5)SOCl2遇水产生白雾,说明生成HCl,Cl元素化合价不变,则S元素化合价不变,所以同时生成二氧化硫;根据反应物和生成物书写方程式.
解答 解:【讨论】(1)SO2Cl2中O元素化合价为-2价、Cl元素化合价为-1价,根据化合物中各元素化合价的代数和为0知,S元素化合价=0-(-2)×2-(-1)×2=+6,
故答案为:+6;
(2)用高锰酸钾和浓盐酸制氯气,反应中KMnO4所含Mn元素化合价由+7价降低为MnCl2中+2价,共降低5价,HCl所含Cl元素化合价由-1价升高为氯气中0价,共升高2价,化合价最小公倍数为10,故KMnO4的系数为2、Cl2的系数为5,根据Mn原子守恒可知MnCl2的系数为2,由K原子守恒可知KCl系数为2,根据Cl原子守恒HCl的系数为16,再由H原子守恒可知水的系数为8,故配平后为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O,
故答案为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O;
【实验探究】Ⅰ.探究反应产物:
(3)SO2Cl2和H2O反应产生白雾,经检验:该无色溶液中的阴离子(除OH-外)只有SO42-、Cl-,说明生成HCl和硫酸,根据反应物和生成物书写方程式为SO2Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
Ⅱ.探究反应进行的程度.
(4)亚硫酸的酸性小于盐酸,亚硫酸盐和盐酸酸化的氯化钡不反应,硫酸根离子和盐酸酸化的氯化钡反应生成硫酸钡白色沉淀,用NaOH吸收的气体溶液中加入盐酸酸化的氯化钡溶液产生白色沉淀,说明剩余气体时SO2被Cl2氧化,即剩余气体中必然存在含有SO2和Cl2,因此SO2与Cl2生成SO2Cl2的反应是可逆反应,
故答案为:由实验中产生的白色沉淀是BaSO4而不是BaSO3,说明用NaOH溶液吸收剩余气体时SO2被Cl2氧化,即剩余气体中必然存在含有SO2和Cl2,因此SO2与Cl2生成SO2Cl2的反应是可逆反应;
【质疑】(5)SOCl2遇水产生白雾,说明生成HCl,Cl元素化合价不变,则S元素化合价不变,所以同时生成二氧化硫,反应方程式为SOCl2+H2O=SO2+2HCl;
SO2 与SOCl2中硫元素均为+4价,SO2与Cl2反应如果生成SOCl2,Cl元素化合价降低、S元素化合价不变,不符合氧化还原反应特点,所以不会生成SOCl2,
故答案为:SOCl2+H2O=SO2+2HCl;SO2 与SOCl2中硫元素均为+4价,SO2与Cl2反应不会生成SOCl2.
点评 本题考查性质实验方案评价,为高频考点,涉及化合价的判断、氧化还原反应等知识点,侧重考查学生知识运用能力、获取信息利用信息解答问题能力,熟悉基本理论、元素化合物性质是解本题关键,难点是证明SO2与Cl2是可逆反应的理由.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
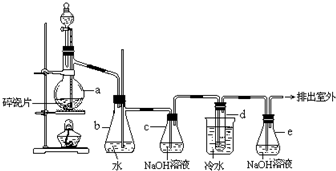
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
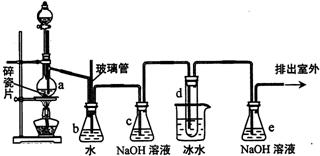
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度(g/mL) | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯→乙二醇:CH2═CH2$\stackrel{加成}{→}$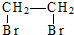 $\stackrel{取代}{→}$ $\stackrel{取代}{→}$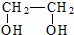 | |
| B. | 溴乙烷→乙醇:CH3CH2Br$\stackrel{消去}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷→1,3-丁二烯:CH3CH2CH2CH2Br$\stackrel{消去}{→}$CH3CH2CH=CH2$\stackrel{加成}{→}$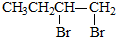 $\stackrel{消去}{→}$CH2═CH-CH═CH2 $\stackrel{消去}{→}$CH2═CH-CH═CH2 | |
| D. | 乙烯→乙炔:CH2═CH2$\stackrel{加成}{→}$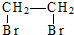 $\stackrel{消去}{→}$CH≡CH $\stackrel{消去}{→}$CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二次平衡时,Z的浓度为0.2 mol•L-1 | |
| B. | m=3 | |
| C. | X与Y的平衡转化率之比为1:2 | |
| D. | 加入Z后平衡没移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com