
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3kJ/mol. | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+KNO3(aq)△H<-57.3kJ/mol. | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3kJ/mol. | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H>-57.3kJ/mol. |
分析 中和热是在稀溶液中,强酸、强碱发生中和反应生成1mol水时放出的热量,应注意的是:①稀的酸和碱溶液,如果是浓硫酸,在和碱反应时被稀释放热;②强酸和强碱,如果是弱酸,电离吸热;③衡量标准是生成1mol水.据此分析.
解答 解:A、HNO3和 KOH分别是强酸和强碱,当其反应生成1mol水时,放出的热量即为57.3kJ/mol,故反应热△H应等于-57.3 kJ/mol,故A错误;
B、NH3•H2O是弱碱,电离吸热,故当NH3•H2O与HNO3生成1mol水时,放出的热量小于57.3 kJ,则反应热△H应大于-57.3 kJ/mol,故B错误;
C、CH3COOH是弱碱,电离吸热,故当CH3COOH与KOH生成1mol水时,放出的热量小于57.3 kJ,则反应热△H应大于-57.3 kJ/mol,故C错误;
D、CH3COOH是弱酸,电离吸热,故当CH3COOH与氢氧化钠溶液反应生成1mol水时,放出的热量小于57.3 kJ,则反应热△H应大于-57.3 kJ/mol,故D正确.
故选D.
点评 本题考查了中和热的热化学方程式的书写,应注意的是弱电解质电离吸热,对反应热有影响,难度不大,掌握基础是解题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)═SO2(g)△H<-297.3kJ•mol-1 | |
| B. | 2SO2(g)═2S(s)+2O2(g)△H=+297.3kJ•mol-1 | |
| C. | 1molSO2的键能总和小于1molS和1molO2的键能总和 | |
| D. | 1molSO2具有的总能量大于1molS和1molO2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
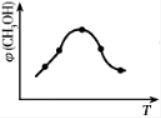
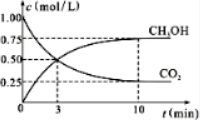
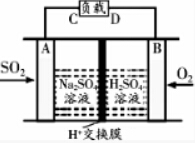
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:乙>甲 | B. | 平衡时HI的百分含量:乙=丙 | ||
| C. | I2的转化率:丙=甲 | D. | HI的平衡浓度:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H=+1.9 kJ•mol-1,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,则含1mol NaOH的稀溶液与1mol的稀醋酸完全中和,放出的热量也等于57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g))△H=a kJ•mol-1、2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O (l)△H=+1135.7kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1135.7kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=+1135.7kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com