
| A. | ③④⑤ | B. | ④⑤ | C. | ④⑤⑦ | D. | ③④⑤⑦ |
分析 7中物质都属于烃,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的有机物一般应具有还原性,往往应含有不饱和键,以此解答该题.
解答 解:①甲烷为饱和烃,不能与酸性高锰酸钾溶液和溴水反应,故①错误;
②苯不能与酸性高锰酸钾溶液和溴水反应,故②错误;
③聚乙烯不含不饱和键,不能与酸性高锰酸钾溶液和溴水反应,故③错误;
④聚异戊二烯含有碳碳双键,可既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故④正确;
⑤2-丁炔含有不饱和键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故⑤正确;
⑥环己烷不含不饱和键,不能与酸性高锰酸钾溶液和溴水反应,故⑥错误;
⑦环己烯含有不饱和键,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色,故⑦正确.
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,题目难度不大,注意把握有机物官能团或基团的性质,性质官能团的性质解答该题.


科目:高中化学 来源: 题型:推断题

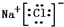 、
、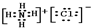
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
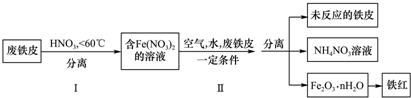
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量CO2气体通入水玻璃中可制得硅酸和纯碱 | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移电子0.1 mol | |
| C. | 1 L 2 mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 | |
| D. | 漂白粉溶于水能导电,故漂白粉是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2+>A2+>B2+>C2+ | B. | C2+>B2+>A2+>D2+ | C. | D2+>C2+>A2+>B2+ | D. | A2+>B2+>D2+>C2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
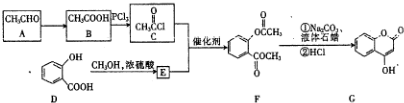
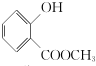 ,G中所含官能团的名称为酯基、碳碳双键、羟基;
,G中所含官能团的名称为酯基、碳碳双键、羟基;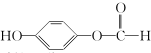 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com