
����Ŀ����ͼ��ʾ��B�� D����ѧ��ѧ����������D��������Ӧ����㷺��

(1)д������A�����ᷴӦ�����ӷ���ʽ_____��
(2)̽��A��B��Ӧ���������ʣ�����Ӧ�������еIJ�����������ձ��У�����100mLϡ���ᣬ������ȫ�ܽ⣬ (�������ȫ���ܽ����Һ�������)����Ӧ������������ų� (���ý����ɰ�ϡHNO3��ԭΪNH4NO3)����Ӧ�����Һ�л����μ�4mol��L��1��NaOH��Һ���������������ʵ��������NaOH��Һ������Ĺ�ϵ��ͼ��ʾ��
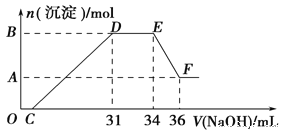
��д��DE�η�����Ӧ�����ӷ���ʽ��_____��
��B��A�IJ�ֵΪ_____mol��
����c(HNO3)=_____��
���𰸡�Fe3O4 +8H+=2Fe3+ +Fe2++4H2O NH4++OH���TNH3H2O 0.008 1.48mol/L
��������
��1��B��D����ѧ��ѧ����������D��������Ӧ����㷺����DΪFe���������е�ȼ����A����AΪFe3O4��B��Fe3O4���������û��������ʣ���BΪAl�����߷������ȷ�Ӧ���ɴ��Ƴ�CΪAl2O3���ݴ˷�������
��2��O��C ֮��û�г������ɣ�˵�����������O��C֮�䷢���ķ�Ӧ����кͷ�Ӧ�����ӷ���ʽΪH++OH-�TH2O��
D��Eһ�γ���������û�з����仯��ΪNH4NO3��NaOH��Ӧ����Ӧ�����ӷ���ʽΪ��NH4++OH-�TNH3H2O��
E��F֮������������٣��϶�����ΪAl(OH)3�ܽ�������������Һ�У���Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O���Դ˽��н��
��1����������������֪��AΪFe3O4����Fe3O4��ϡ���ᷴӦ�����ӷ���ʽΪ��Fe3O4 +8H+=2Fe3+ +Fe2++4H2O��
�ʴ�Ϊ��Fe3O4 +8H+=2Fe3+ +Fe2++4H2O��
��2����OC����H++OH-�TH2O��CD��Ӧ����������������������������D��Eһ�γ���������û�з����仯��ΪNH4NO3��NaOH��Ӧ�����ӷ���ʽΪ��NH4++OH-�TNH3H2O��
�ʴ�Ϊ��NH4++OH-�TNH3H2O��
��E��F֮������������٣�ΪAl(OH)3�ܽ�������������Һ�У�
�䷴Ӧ����ʽΪAl(OH)3+NaOH=NaAlO2+2H2O��
EF�ε�n��NaOH��=4mol/L��2��10-3L=0.008mol��
Al(OH)3+NaOH=NaAlO2+2H2O
1 mol 1mol
0.008 mol 0.008mol
Al(OH)3������0.008mol������Al3+Ҳ��0.008mol��
����B��A��ֵΪ0.008 mol��
�ʴ�Ϊ��0.008��
�ۼ���34 mLNaoH��Һʱ������Ϊ�����ƣ�ԭ��Һ������ת��ΪΪ�����ƺ�һˮ�ϰ������֣����������������ĵ�����Ϊ��4 mol/L��34��10-3L=0.136mol��һˮ�ϰ������ʵ���Ϊ��4mol/L����34-31����10-3 L=0.012 mol��
������������ʵ���Ϊ��0.136mol+0.012mol=0.148mol��������ҺŨ��Ϊ��![]() =1.48mol/L��
=1.48mol/L��
�ʴ�Ϊ��1.48mol/L��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ A��B��C��D��E��F �����ֶ���������Ԫ�أ�ԭ��������������A��C��F �ĵ����ڳ����³���̬��B ��ԭ������������������Ӳ����� 2 ����A �� D ͬ���壬C ����̬�⻯������������������ˮ���ﷴӦ��E �ǵؿ��к�����ߵĽ���Ԫ�ء���ش��������⣺
(1)F ��Ԫ�ط���Ϊ______��B��C��D��E ����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����(дԪ�ط���)_____��
(2)B ��Ԫ�����ڱ��е�λ��Ϊ_____��B ����Ԫ���γɵĶ�Ԫ������ĵ���ʽΪ_____��
(3)����Ԫ�ص�����������Ӧ��ˮ����������ǿ����(д��ѧʽ)_____��
(4)�� A,C,F ��ɵ�һ�ֳ��������нṹ�а���_____(ѡ�������Ӽ��������Լ��������Ǽ��Լ���)
(5)���� B ��Ԫ�� C ������������Ӧˮ�����Ũ��Һ������Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��Ϊ��ѧ��ѧ�еij������ʣ�����֮���ת����ϵ��ͼ��ʾ(���ֲ�������)������˵������ȷ����
![]()
A. X��Y��Z��������һ����ͬ��Ԫ�أ���Ԫ�ؿ����ǽ���Ԫ��Ҳ�����Ƿǽ���Ԫ��
B. ����W�����ǻ����Ҳ�����ǵ���
C. ����ת����ϵ�в����ܳ����û���Ӧ
D. ��X��Y��Z�о�����һ�ֳ�������Ԫ�أ���W������ǿ��Ҳ������ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��������ͼװ����ȡ������̽���������й����ʡ�

(1)��ͼװ��A��ƿ���Լ���ѡ��______(�����)����Ũ���� �ڼ�ʯ�� ������������ ���ռ���壻ʵ������ȡ������������һ�ֹ��������ȵķ�����д���÷����Ļ�ѧ����ʽ______________________��
(2)��̽���������ܽ��ԣ���ͼ����K2�ĵ���ĩ��������ͼװ���е�_________װ��(�����)����װ��D�м��������ر�K1��K2����K3��������Ȫ��ʵ�������______________________��
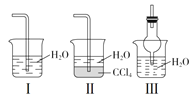
(3)��̽�������Ļ�ԭ�ԣ����K1��K3��K2������������ȡ����������������װ�ã�D�а�����������Ӧ�������̣��÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
(4)�����������£���������ˮ�зֽ�����İ��ܹ���������������������(HNO2)����Ӧ�Ļ�ѧ����ʽΪ__________������Ӧ����0.3 mol���ӷ���ת��ʱ�����������������Ϊ_____g(С���������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ�ã�����װ������ȥ��������������ǣ� ��
|
|
|
|
A�����հ����������� | B����SO2��Ba(NO3)2��Ӧ���BaSO3���� | C�������屽�ͱ��Ļ���� | D. ��֤HCl���ܽ��� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˷�ֹ��������������ʦ���˺ܶ�취����������Щ���ý����ڿ���������������Ӧ����������һ�����ܵ�����Ĥ�����Ա����ڲ��������������������( )
���� ���� ���� ��þ
A. �٢� B. �ڢ� C. �ۢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������ڽ���ͨ�Ե���
A.���硢����B.�����õ���չ��
C.�ܷе��D.�н�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Һ��������������Ĺ�ͬ���� �� ��
A.��ɢ�ʿ���ֱ������l��100nm֮��
B.��һ��ƽ�й�����ʱ���Ӳ��涼���Կ���һ������
C.��ɫ���ʺ��ɫ
D.���Ƿ�ɢϵ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com