
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1: 己知:A中放有浓硫酸;B中放有乙醇、无水碳酸钠;D中放有饱和碳酸钠溶液.
有关有机物的沸点.
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用:催化剂和;反应中加入过量的乙醇,目的是 .
(2)仪器C的名称是 , 其作用有冷凝乙酸乙酯和 , 若反应前向D中加入几滴酚酞,溶液呈红色.实验完毕后,将烧杯D中的溶液充分振荡、静止,现象为 .
(3)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式: .
(4)现拟分离乙酸乙酯(含少量乙醇和乙酸)粗产品,如图2是分离操作步骤流程图: 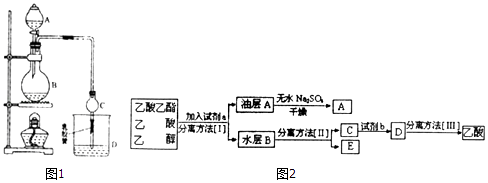
则试剂a是: , 试剂b是: . 分离方法I是 , 分离方法II是
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都先加NaOH溶液中和酯中过量的酸,然后用蒸馏水将酯分离出来.甲、乙两人实验结果如下:甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质;丙同学分析了上述实验目标产物后认为甲、乙的实验没有成功. 试解答下列问题:
①甲实验失败的原因是: .
②乙实验失败的原因是: .
【答案】
(1)吸水剂;提高乙酸的转化率
(2)球形干燥管;防止倒吸;红色变浅(或褪去)且出现分层现象
(3)CH3COOH+CH3CH218OH ![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
(4)饱和Na2CO3溶液;硫酸;分液;蒸馏
(5)所加的NaOH溶液较少,没有将余酸中和;所加的NaOH溶液过量使酯完全水解
【解析】解:(1)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,反应中加入过量乙醇的目的是提高乙酸的转化率(或提高乙酸乙酯的产率), 所以答案是:吸水剂;提高乙酸的转化率;(2)仪器C具有球形特征,为球形干燥管,乙酸、乙醇易溶于碳酸钠溶液,会导致装置内气体减小,容易发生倒吸,球形干燥管的管口伸入液面下可能发生倒吸,但球形干燥管体积大,可冷凝乙酸乙酯,也可以防止倒吸,碳酸钠为强碱弱酸盐,水解生成碳酸氢根离子和氢氧根离子,离子方程式:CO32﹣+H2OHCO3﹣+OH﹣;碳酸钠溶液显碱性,遇到酚酞变红,实验完毕后,将烧杯D中的溶液充分振荡、静止,乙酸和碳酸钠反应而使溶液红色变浅,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,溶液分层,上层无色油体液体,
所以答案是:球形干燥管;防止倒吸;红色变浅(或褪去)且出现分层现象;(3)羧酸与醇发生的酯化反应中,羧酸中的羧基提供﹣OH,醇中的﹣OH提供﹣H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为CH3COOH+CH3CH218OH ![]() CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O,
所以答案是:CH3COOH+CH3CH218OH ![]() CH3CO18OC2H5+H2O;(4)由分离流程可知,加试剂a为碳酸钠,分离方法I为分液,油层含乙酸乙酯和水,加无水硫酸钠可吸收水,A为乙酸乙酯;水层含乙醇、乙酸钠、碳酸钠,分离方法II为蒸馏,E为乙醇,C中含乙酸钠、碳酸钠,加试剂b为硫酸,分离方法Ⅲ为蒸馏,
CH3CO18OC2H5+H2O;(4)由分离流程可知,加试剂a为碳酸钠,分离方法I为分液,油层含乙酸乙酯和水,加无水硫酸钠可吸收水,A为乙酸乙酯;水层含乙醇、乙酸钠、碳酸钠,分离方法II为蒸馏,E为乙醇,C中含乙酸钠、碳酸钠,加试剂b为硫酸,分离方法Ⅲ为蒸馏,
由上述分析可知a为饱和Na2CO3溶液,I为分液,II为蒸馏,b为硫酸,
所以答案是:饱和Na2CO3溶液;硫酸;分液;蒸馏;(5)①甲得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应,
所以答案是:所加的NaOH溶液较少,没有将余酸中和;②乙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,
所以答案是:所加的NaOH溶液过量使酯完全水解.


科目:高中化学 来源: 题型:
【题目】欲除去某溶液里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( )
A. NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸再加热
B. KNO3溶液(AgNO3):加入过量KCl溶液,过滤
C. NaCl溶液(Br2):加CCl4,萃取分液
D. 碘单质I2(NaCl):加热升华后,再凝华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中B、E为金属单质,D为气体。反应① ②是置换反应,反应① ② ③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
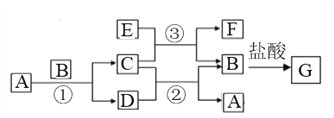
(1)C的化学式_____________, E与足量盐酸反应的离子方程式_________________;
(2)反应③ 化学方程式_______________________;E加入过量的NaOH溶液对应离子反应方程式_______________________;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式_________________;
(4)F与氢氧化钠反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19g某二价金属的氯化物ACl2中含有0.4mol Cl- 离子,ACl2的摩尔质量是 _____________,A的相对原子质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.工业制取硫酸过程中生成的SO2可循环利用
B.钢铁因含杂质而容易生锈,所以合金一定不耐腐蚀
C.沙子、石英、水晶、硅藻土都是天然存在的二氧化硅
D.在医疗上硫酸亚铁可用作生产防治缺铁性贫血的药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于ⅣA族元素,下列叙述中不正确的是( )
A. SiO2和CO2中Si和O,C和O之间都是共价键
B. C、Si、Ge的最外层电子数都是4,次外层电子数都是8
C. CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D. 该族元素的主要化合价是+4和+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L酒精所含分子数为0.5NA
B. 40gNaOH含有氧原子数为NA
C. 1 L NaCl溶液中,所含离子总数为2 NA
D. 标准状况下,22.4L氢气含有NA个氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com