
溴酸银(AgBrO3)溶解度随温度变化曲线如下图所示。下列说法错误的是( )
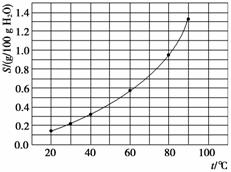
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
________________________________________________________________________
_______________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制取SO2的反应原理为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
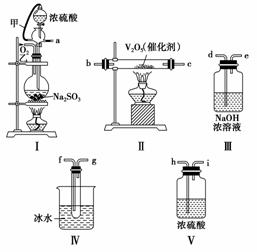
(1)这些装置的连接顺序(按气体从左到右的方向)是________→________→________→________→________→________→________→________(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是__________________________________________________________
__________________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________________
__________________________________________________________。
(4)Ⅳ处观察到的现象是__________________________________________________________。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会________(填“增大”、“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,对pH=3的醋酸溶液(Ⅰ)和pH=11的氢氧化钠溶液(Ⅱ),下列说法正确的是( )
A.Ⅰ和Ⅱ的物质的量浓度均为0.001 mol·L-1
B.将Ⅰ稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C.Ⅰ和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.Ⅰ和Ⅱ等体积混合后,溶液中离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)吸收液吸收SO2的过程中,pH随n(SO )∶n(HSO
)∶n(HSO )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:________________________________________________________________________。
(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:
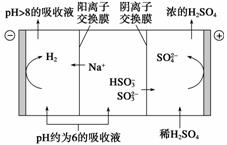
当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是(双选)( )
A.MnS的Ksp比CuS的Ksp小
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=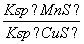
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O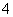 )
)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。某研究性学习小组的同学利用滴定分析法进行下面两项定量分析。
(1)测定NaOH和Na2CO3的混合液中NaOH的含量。实验操作为先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为______________,为何此种情况能测出NaOH的含量?________________。
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?________________________________________________________________________,
请说明理由:__________________________________________________________________。
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合

溶液稀释至250 mL,然后用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O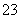 ===2I-+S4O
===2I-+S4O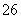 )。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
)。取用Na2S2O3的标准溶液应该用________式滴定管。有关实验数值如下表所示(第一次滴定终点的数据如图所示,请将读得的数据填入表中)。
| 滴定次数 | 待测液的 体积(mL) | 滴定前的 读数(mL) | 滴定后的 读数(mL) |
| 第一次 | 25.00 | 0.00 | V=________ |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________,下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
①溶液、②胶体、③悬浊液、④乳浊液是四种常见的分散系,静置,分散质和分散剂很快分离,其中产生沉淀的是__________;分散系分层的是____________;用一束平行光照射,出现一条明亮“光路”的是________;能通过半透膜的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com