
| A、向Ba(OH)2溶液中滴加NH4HSO4溶液刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| B、向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、在NaOH溶液中通入少量的SO2气体:SO2+OH-=HSO3- |
| D、二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浑浊的苯酚试液中加入饱和Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| B | AgCl沉淀中滴入Na2S溶液 | 白色沉淀变黑色 | Ag2S比AgCl更难溶 |
| C | 向AlCl3溶液中滴入适量NaOH溶液 | 产生白色沉淀 | Al(OH)3不溶于碱 |
| D | 用玻璃棒蘸取某溶液在酒精喷灯上灼烧 | 火焰呈黄色 | 说明该溶液中一定含钠元素 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果正确的是( )| A、原混合酸中HNO3的物质的量为0.1 mol |
| B、OA段产生的是氢气,BC段产生NO |
| C、AB段的反应为Fe+2Fe(NO3)3═3 Fe(NO3)2 |
| D、H2SO4浓度为2.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①④⑤ |
| C、①⑤ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水清洗试管内壁附着的银镜 |
| B、用饱和Na2CO3溶液除去乙醇中少量的乙酸和水 |
| C、制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2.9g C2H
| ||
| B、标准状况下,22.4L乙酸的分子数为NA个 | ||
| C、一个氯原子的质量是35.5NAg | ||
| D、铝与氢氧化钠溶液反应,每生成1mol氢气,铝就失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| A、-218 kJ/mol |
| B、-109 kJ/mol |
| C、+218 kJ/mol |
| D、+109 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Cl2+2KBr═Br2+2KCl | ||||
B、CaCO3
| ||||
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||||
D、2CuO+2CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
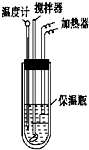 在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com