
 用如图装置电解制备N2O5 ,下列有关说法正确的是( )
用如图装置电解制备N2O5 ,下列有关说法正确的是( )| A、N2O5在惰性电极2处产生 |
| B、在惰性电极2处有氢气产生 |
| C、在惰性电极1处发生还原反应 |
| D、在惰性电极2处有NO产生 |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:

| A、使用此装置可减少导致酸雨的气体形成 |
| B、装置内发生了化合反应和分解反应 |
| C、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2 |
| D、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中含SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①④ | C、①③ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量Fe3+的溶液:Na+、SCN-、OH-、NO3- |
| B、碱性溶液:K+、Ca2+、Cl-、CO32- |
| C、酸性溶液:Na+、NH4+、SO42-、Cl- |
| D、含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I- Cl- Al3+ S2- |
| B、Na+ K+ NH4+ Ba2+ |
| C、Br- Cl- S2- CO32- |
| D、SO32- NO3- SO42- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na在足量O2中燃烧,消耗l mol O2时转移的电子数是4×6.02×1023 |
| B、盐酸和醋酸的混合溶液pH=1,该溶液中c(H+)=0.1 mol/L |
| C、1 L 0.1 mol/L NH4Cl溶液中的NH4+数是0.1×6.02×1023 |
| D、标准状况下2.24 L Cl2中含有0.2 mol 共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
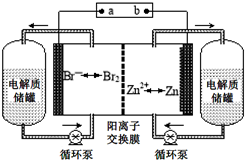 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| B、放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C、充电时电极a连接电源的负极 |
| D、放电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com