
如图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是( )
A.电源a极为负极
B.Ⅰ极上铜放电而逐渐消耗
C.Ⅱ极上发生的电极反应为Fe-2e-===Fe2+
D.Ⅱ极上Cu2+放电而使溶液中Cu2+浓度逐渐变小
科目:高中化学 来源: 题型:
已知2SO2+O2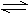 2SO3是一个正反应放热的可逆反应。如果反应在密闭容器中进行,则下列有关途述正确的是
2SO3是一个正反应放热的可逆反应。如果反应在密闭容器中进行,则下列有关途述正确的是
A.使用催化剂是为了加快反应 速率,提高生产效率
速率,提高生产效率
B.升高温度可加快逆反应速率但不能改变正反应速率
C.一定条件下,SO2可100%转化为SO3
D.任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应和反应类型不相符的是
A.甲苯与浓硝酸、浓硫酸混合反应制TNT(取代反应)
B.苯与乙烯在催化剂存在下反应制取乙苯(取代反应)
C.甲苯与酸性KMnO4溶液反应(氧化反应)
D.甲苯制取甲基环已烷(加成反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应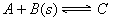 达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
A. A为固体,C为气体,正反应为放热反应 B. A为气体,C为固体,正反应为放热反应
C. A为气体,C为固体,正反应为吸热反应 D. A、C均为气体,正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应CO + H2O(g) CO2 + H2,达到平衡时,
CO2 + H2,达到平衡时,
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为 。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度c (H2) = c mol/L,
①a、b、c之间的关系式是 ②当a = b时,a = c。
查看答案和解析>>
科目:高中化学 来源: 题型:
用图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量。下列叙述不正确的是( )
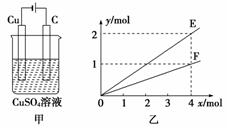
A.E表示反应生成Cu的物质的量
B.E表示反应消耗H2O的物质的量
C.F表示反应生成H2SO4的物质的量
D.F表示反应生成O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中,铁腐蚀由快到慢的顺序为(未标明的电解质溶液为水)( )
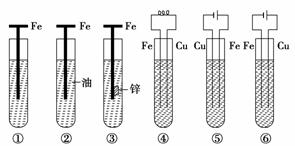
A.⑥>④>①>②>③>⑤
B.⑤>③>①>②>④>⑥
C.⑤>④>①>②>③>⑥
D.⑤>④>②>①>③>⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液中离子关系的说法正确的是( )
A.0.1 mol·L-1 NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO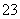 )+c(HCO
)+c(HCO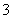 )+c(H2CO3)
)+c(H2CO3)
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH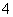 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO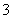 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
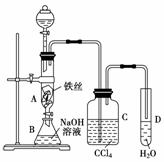
(1)写出A中反应的化学方程式:_____________________________。
(2)观察到A中的现象是_____________________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关反应的化学方程式:____________________________________。
(4)C中盛放CCl4的作用是______________________________________。
(5)要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com