
| m |
| M |
| n |
| V |
| 1.92g |
| 64g/mol |
| 0.03mol×8 |
| 3 |
| 0.02mol |
| 0.05L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、将铝片加入少量烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| B、利用醋酸溶解含碳酸钙的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| D、FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
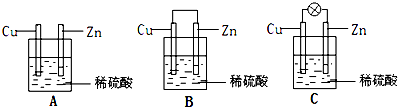
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
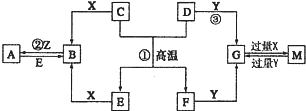
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | ||
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的102倍 | ||
| C、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | ||
D、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com