
|
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA |
| B、1L1mol/L的NaClO溶液中含有ClO-的数目为NA |
| C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D、常温常压下,8gO2含有2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
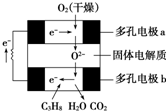 某固体燃料电池以固体氧化铝、氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断不正确的是( )
某固体燃料电池以固体氧化铝、氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断不正确的是( )| A、在电池内部氧离子(O2-)向负极移动 |
| B、b极对应的电极反应式为:C3H8+10O2--20e-═3CO2+4H2O |
| C、a极对应的电极反应式为:10H2O+5O2+20e-═20OH- |
| D、用该电池作电源电解CuSO4溶液时,每消耗1molC3H8时理论上能得到Cu的最大量为10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Al3+、Cl?、SO32- |
| B、Na+、K+、OH?、[Al(OH)4]- |
| C、H+、K+、SO42-、NO3? |
| D、Na+、NH4+、Cl-、OH? |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中MnO2作催化剂 |
| B、盐酸未完全反应 |
| C、被还原的HCl少于0.2 mol |
| D、反应产生2.24 L氯气(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com