
| A、原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B、当滴入少量的NaOH,促进了HA的电离,溶液的pH降低 |
| C、当恰好完全中和时,溶液中c(Na+)>c(A-)>c(OH-)>c(H+) |
| D、当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、镓的金属性比铝弱 |
| B、镓的常见化合价为+3 |
| C、镓的原子半径比铝大 |
| D、镓的单质有导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示反应2A(g)?B(g)+C(g)△H>0从平衡状态Ⅰ移到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化可能为( )
如图表示反应2A(g)?B(g)+C(g)△H>0从平衡状态Ⅰ移到平衡状态Ⅱ的反应速率(v)与时间(t)的曲线,此图表示的变化可能为( )| A、加入催化剂 | B、加压 |
| C、增加A的浓度 | D、增加B的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A、三种元素的原子半径的大小顺序是W<Y<X |
| B、X元素的氧化物、氢化物的水溶液都呈酸性 |
| C、Y元素的单质是非金属单质中唯一能跟水发生激烈反应的单质 |
| D、W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,28g乙烯含有NA个C=C键 |
| B、1mol Cl2和足量NaOH溶液反应转移2NA个电子 |
| C、1L 0.1mol?L-1NaHCO3溶液含有0.1NA个CO32- |
| D、标况下,22.4升的乙醇含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化氢气体通入硫酸铜溶液中:H2S+Cu2+=CuS↓+2H+ |
| B、铁与足量稀硝酸反应:Fe+4H++NO3-=Fe2++4H2O+NO↑ |
| C、醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、等物质的量的Ba(OH)2与Al2(SO4)3在溶液中反应:Ba2++3OH-+Al3++SO42-=BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳与盐酸溶液反应 |
| B、氢氧化铁与硫酸反应 |
| C、氢氧化钡溶液与硫酸反应 |
| D、氢氧化钠溶液与硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
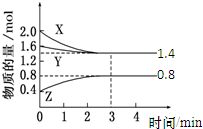 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.2 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3X(g)+Y(g)?2Z(g) |
| C、保持其他条件不变,增大压强,平衡向正反应方向移动 |
| D、温度不变,增大X的浓度,该反应的平衡常数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com