
(12分)A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
|
物质组成 |
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素 原子个数比 |
A和C 1:1 |
B和A 1:4 |
D和E 1:3 |
B和E 1:4 |
请回答下列问题:
⑴C的氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示): _____>___
⑵元素E在周期表中的位置为第 周期 族
⑶请写出两种与乙具有相同电子数的非单核离子的化学式:_____和_____
⑷把D的单质放到NaOH溶液中,反应的化学方程式为:______________________
⑸写出甲的电子式:________________
⑹有200mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3 mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是: _____
⑴ H2O>CH4 (2分) ⑵第三周期VIIA族(2分)
⑶ NH4+和OH- (其他合理答案也可) (2分)
⑷2Al+2NaOH+6H2O=2Na[Al(OH)4]-+3H2↑(2分)
⑸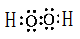 (2分)⑹80 mL(2分)
(2分)⑹80 mL(2分)
【解析】根据元素的结构及性质可知,A、B、C、D、E分别是H、C、O、Al、Cl。
(1)非金属性越强,相应氢化物的稳定性越强,所以是H2O>CH4。
(2)氯元素的原子序数是17,所以位于第三周期VIIA族。
(3)乙是甲烷,含有10个电子,所以具有相同电子数的非单核离子的化学式NH4+和OH-。
(4)铝和氢氧化钠反应生成偏铝酸钠和氢气,方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]-+3H2↑。
(5)甲是双氧水,含有极性键和非极性键,电子式为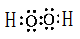 。
。
(6)根据电荷守恒可知,溶液中铝离子浓度是0.3mol/L,要使镁离子完全沉淀,则铝离子将生成偏铝酸钠。镁离子的和铝离子的物质的量分别是0.04mol和0.06mol,所以消耗氢氧化钠至少是0.08mol+0.24mol=0.32mol,其溶液体积是0.32mol÷4mol/L=0.08L=80ml。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中,与D形成的化合物是生活中最常用的调味品 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com