
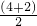 =3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,故答案为:<;
=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,故答案为:<;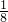 8=1个,Ba2+:1个,O2-:12×
8=1个,Ba2+:1个,O2-:12× =3个,故化学式为PbBaO3,Ba2+ 处于晶胞中心,只有一个,O2-处于晶胞棱边中心,共有12个,故每个Ba2+与12个O2-配位.
=3个,故化学式为PbBaO3,Ba2+ 处于晶胞中心,只有一个,O2-处于晶胞棱边中心,共有12个,故每个Ba2+与12个O2-配位.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期学段考试化学试卷(解析版) 题型:填空题
. (6分) 碳族元素包括C、Si、Cu、Sn、Pb。
(1)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角 120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为 ,每个Ba2+与 个O2-配位。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:山东省高考真题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:山东 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com