
 2AB3��g����ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����������ͼʾ�ɵó����жϽ�����ȷ����
2AB3��g����ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����������ͼʾ�ɵó����жϽ�����ȷ����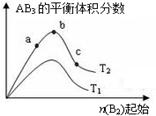
| A���ﵽƽ��ʱ��AB3�����ʵ�����СΪ��c��b��a |
| B���ﵽƽ��ʱ��A2��ת���ʴ�СΪ��b��a��c |
| C����T2��T1��������Ӧһ���Ƿ��ȷ�Ӧ |
| D��a��Ļ�ѧƽ�ⳣ��С��c��Ļ�ѧƽ�ⳣ�� |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
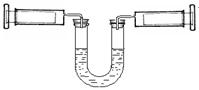
| A�����������ɫ�ȱ������dz |
B������2NO2 N2O4ƽ����ϵ ��������N2O4�ķ����ƶ� N2O4ƽ����ϵ ��������N2O4�ķ����ƶ� |
| C��ѹ����U��������Һ����Ȼ����ˮƽ |
| D����������ע����������������10mL��λ�ã�ƽ���U������Һ����Ȼ����ˮƽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2 (g) ��H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2 (g) ��H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�| ʱ�䣨s�� n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g) + Br2(g) (����ӦΪ���ȷ�Ӧ) �ﵽ��ѧƽ��ʱ��Ҫʹ����������ɫ����ɲ�ȡ�ķ�����
H2(g) + Br2(g) (����ӦΪ���ȷ�Ӧ) �ﵽ��ѧƽ��ʱ��Ҫʹ����������ɫ����ɲ�ȡ�ķ�����| A����Сѹǿ | B����С��� |
| C�������¶� | D������������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2HI(g)����H��0������ƽ�⡣HI���������w(HI)��ʱ��仯��ͼ����(��)��ʾ
2HI(g)����H��0������ƽ�⡣HI���������w(HI)��ʱ��仯��ͼ����(��)��ʾ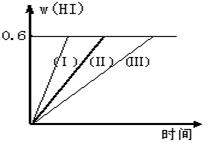
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g) ��H<0���ﵽƽ��ʱ��C���������Ϊ40%���Իش��й����⣺
C(g) ��H<0���ﵽƽ��ʱ��C���������Ϊ40%���Իش��й����⣺| A��һ��������Ӧ�����ƶ� | B��һ�����淴Ӧ�����ƶ� |
| C��һ�����ƶ� | D����һ���ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ĵ���̶���������Һ��PHֵ��С |
| B��Kw��С |
| C��ˮ�ĵ���̶����� |
D��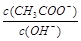 ��� ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ?CH3OH(g)��
?CH3OH(g)��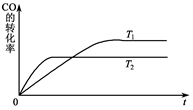
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ϳɰ����������н�NH3Һ�����룬�ɼӿ�����Ӧ���ʣ����N2��H2��ת���� |
| B�����Ṥҵ�У���ӦSO2(g) + 1/2O2(g)= SO3(g) ��H="-98.3" kJ��mol-1,��ѹ���������ԭ�������ʺ�����Ч�� |
| C����ⱥ��ʳ��ˮ���ռ�������ӽ���Ĥ�����ɷ�ֹ������������Cl2���������� |
| D����⾫��ͭʱ��ͬһʱ���������ܽ�ͭ����������������ͭ������С |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com