
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-=3Fe3++NO↑+4H2O | |
| D. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
分析 A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
B.向苯酚钠溶液中通入少量CO2生成碳酸氢根离子;
C.原子不守恒、电荷不守恒;
D.4mol/LNaAlO2溶液和7mol/L盐酸等体积混合,1:1转化为沉淀,则生成3mol沉淀和1mol氯化铝.
解答 解:A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故A错误;
B.向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故B错误;
C.氧化亚铁溶于稀硝酸:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故C错误;
D.4mol/LNaAlO2溶液和7mol/L盐酸等体积混合,1:1转化为沉淀,则生成3mol沉淀和1mol氯化铝,离子反应为4AlO2-+7H++H2O═3Al(OH)3↓+Al3+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.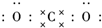 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C7H15OH | B. | C6H13OH | C. | C5H12OH | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 TiO2•XH2O↓+4HCl
TiO2•XH2O↓+4HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加水稀释的过程中c(OH-)不断增大 | |
| D. | 向含有Na2SO4的BaSO4悬浊液中加水稀释,c(Ba2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 焰色呈黄色 | 原溶液一定是钠盐溶液 |
| B | 向NaOH溶液中滴加足量的MgCl2 溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀, 然后沉淀变蓝色 | KSP[Cu(OH)2]>KSP[Mg(OH)2] |
| C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生 反应 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)═N2O4(g) △H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com