(2008?唐山二模)某学生课外活动小组为了证明和比较二氧化硫和氯气的漂白性,设计了如图所示的实验装置.
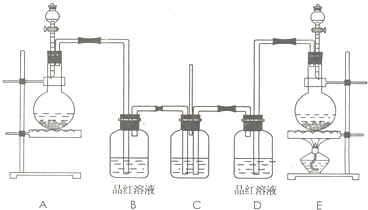
请回答下列问题:
(1)实验室制取氯气的化学方程式为
.
(2)实验室常用浓硫酸与亚硫酸钠固体反应制取二氧化硫,则其反应装置为上图中的
A
A
(填写字母代号),不用稀硫酸与亚硫酸钠溶液制取二氧化硫的理由是
二氧化硫易溶于水
二氧化硫易溶于水
.
(3)装置C中试剂的名称及作用是
氢氧化钠溶液,吸收尾气中的氯气和二氧化硫
氢氧化钠溶液,吸收尾气中的氯气和二氧化硫
.
(4)反应开始后,发现B、D两个装置中的品红溶液都褪色.请设计一个简单实验,证明二氧化硫和氯气漂白品红溶液的原理不同,实验方法、预期的现象和结论为
分别取少量褪色后的溶液于试管中,用酒精灯加热,经二氧化硫漂白的品红溶液恢复红色,说明二氧化硫和品红结合成不稳定的物质,经氯气漂白的品红溶液不会变红,说明氯气将品红溶液氧化褪色
分别取少量褪色后的溶液于试管中,用酒精灯加热,经二氧化硫漂白的品红溶液恢复红色,说明二氧化硫和品红结合成不稳定的物质,经氯气漂白的品红溶液不会变红,说明氯气将品红溶液氧化褪色
.
(5)若将B、D装置中的品红溶液换为滴有酚酞的氢氧化钠溶液,反应一段时间后,B、D中的现象是
B、D装置的红色都退去
B、D装置的红色都退去
.
(6)实验结束后,经检验,发现装置C中的溶液呈碱性,并且含有SO
42-.试写出C中生成的离子方程式(有多种可能,只写出一个即可)
Cl2+SO2+4OH-=SO42-+2Cl-+2H2O(或ClO-+SO32-=SO42-+Cl-)
Cl2+SO2+4OH-=SO42-+2Cl-+2H2O(或ClO-+SO32-=SO42-+Cl-)
.

