
| A、一定大于7 |
| B、一定小于7 |
| C、一定等于7 |
| D、大于.小于.或等于7都有可能 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
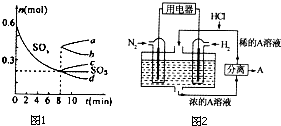 运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | KBr | AlCl3 | 单质硼 | SiCl4 | |
| 熔点 | 801 | 730 | 190(0.25MPa) | 2300 | -70 |
| 沸点 | 1413 | 1380 | 180 | 2500 | 57 |
| A、SiCl4是分子晶体 |
| B、单质硼是原子晶体 |
| C、AlCl3加热能升华 |
| D、MgCl2所含离子键的强度比NaCl大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com