
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | V1L④与V2L①混合,若混合后溶液pH=7,则V1<V2 | |
| C. | 分别加水稀释10倍后,四种溶液的pH①>②>④>③ | |
| D. | ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
分析 ①中c(NH3.H2O)>0.001mol/L,②中c(NaOH)=0.001mol/L③中c(CH3COOH)>0.001mol/L,④中c(HCl)=0.001mol/L,
A.醋酸根离子会抑制醋酸的电离;醋酸钠与盐酸反应生成醋酸;
B.氨水为弱碱,c(NH3.H2O)>0.001mol/L,氯化氢为强电解质,c(HCl)=0.001mol/L,若溶液为中性,则盐酸的体积一定大于氨水的体积;
C.弱电解质溶液中存在电离平衡,酸或碱加水稀释相同的倍数,弱电解质的pH变化小于强电解质;
D.②③等体积混合,酸过量,溶液呈酸性.
解答 解:①中c(NH3.H2O)>0.001mol/L,②中c(NaOH)=0.001mol/L③中c(CH3COOH)>0.001mol/L,④中c(HCl)=0.001mol/L,
A.醋酸根离子会抑制醋酸的电离,所以醋酸的电离程度减小,则溶液的pH增大;醋酸钠与盐酸反应生成醋酸,溶液的酸性减弱,即pH增大,所以③、④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大,故A正确;
B.由于c(NH3.H2O)>0.001mol/L、c(HCl)=0.001mol/L,若V1L④与V2L①溶液混合后,若混合后溶液pH=7,则必须满足盐酸体积大于氨水,即V1>V2,故B错误;
C.弱电解质溶液中存在电离平衡,酸或碱加水稀释相同的倍数,弱电解质的pH变化小于强电解质,所以四种溶液的pH①>②>④>③,故C正确;
D.②中c(NaOH)=0.001mol/L③中c(CH3COOH)>0.001mol/L,如果②③等体积混合,酸过量,溶液呈酸性,c(H+)>c(OH-),故D正确;
故选B.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断等知识点,根据弱电解质的特点、酸碱混合溶液氢离子浓度的计算方法、电荷守恒进行分析解答,难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法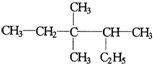 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 温度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 达到相同程度所用的时间/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用明矾和漂白粉处理自来水,二者的作用原理相同 | |
| B. | 室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 可用澄清的石灰水鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
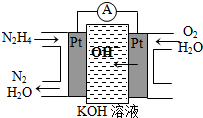 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
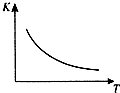 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| B. | 将金属Li放于石蜡中密封保存 | |
| C. | 将NaOH溶液存放于磨口玻璃塞的试剂瓶 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3YZ4 | B. | X2YZ3 | C. | XYZ4 | D. | X2YZ4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com