
分析 (1)化合物中S元素常见负化合价为-2价;
(2)根据电解原理分析电解精炼铜的阳极材料;依据溶液中阳离子的放电顺序回答;
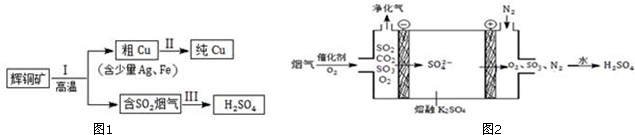
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2;
(4)①溴水具有强氧化性,亚硫酸根具有还原性,据此解答即可;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低,据此解答即可;
(5)H3PO2是一元中强酸,部分电离生成氢离子和H2PO2-,NaH2PO2为正盐,水解呈碱性.
解答 解:(1)化合物中S元素常见负化合价为-2价,故Cu的化合价为+1,故答案为:+1;
(2)①电解法炼铜时,阳极发生氧化反应、阴极发生还原反应,所以阳极为粗铜板,粗铜板中的金、银还原性比铜的弱,反应后以单质的形式在电解槽阳极的槽底,在电解槽的阴极铜离子得到电子生成金属铜,该电极反应为:Cu2++2e-═Cu,故答案为:正;
②由于Cu2+的氧化性大于Fe2+的氧化性,故溶液中的铜离子放电析出,故答案为:Cu2+的氧化性大于Fe2+的氧化性;
③阳极为铜,含有铁,铁先被氧化,而阴极只有铜析出,则铜离子浓度减小,故答案为:减小;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑;
(4)①溴水具有强氧化性,亚硫酸根具有还原性,发生反应的离子反应方程式为:SO32-+Br2+H2O=SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+;
②生成沉淀越多,说明烟气中二氧化硫含量越高,脱除率越低,故答案为:低;
(5)H3PO2是一元中强酸,部分电离生成氢离子和H2PO2-,电离方程式为H3PO2?H2PO2-+H+,NaH2PO2为正盐,水解呈碱性,
故答案为:H3PO2?H2PO2-+H+;正盐;弱碱性.
点评 本题考查了物质分离提纯的方法和流程分析应用,主要涉及物质性质的理解,为高频考点,侧重于学生的分析能力的考查,本题涉及电解知识,注意把握电解原理,难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:填空题

| 尾 气 吸 收 装 置 |  |  |
| 处理气体 | ①③ | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究硫及其化合物的性质有重要意义.
研究硫及其化合物的性质有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有10NA个质子 | |
| B. | 1 mol/LCH3COONa溶液中含有1 mol/LCH3COO- | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入BaCl2 溶液中至饱和,无沉淀产生,再通入Cl2,产生白色沉淀 | |
| B. | 纯锌与稀硫酸反应产生氢气速率较慢;再加入少量CuSO4 固体,速率不改变 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉可以溶解 | |
| D. | 向AlCl3 溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4 溶液,沉淀消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com