
| A. | 109 | B. | 118 | C. | 136 | D. | 137 |
科目:高中化学 来源: 题型:解答题
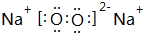 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二次电池的放电与充电属于可逆反应 | |
| B. | 碱金属单质在空气中燃烧都生成过氧化物 | |
| C. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| D. | 在周期表过渡元素中寻找催化剂恒和耐腐蚀、耐高温的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
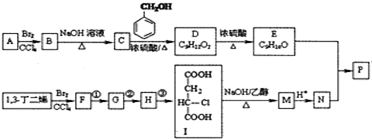
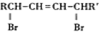 (R、R′表示烃基)
(R、R′表示烃基) (其中R1~R2表示氢或烃基)
(其中R1~R2表示氢或烃基) .
. .
. (其中任一种).
(其中任一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的 某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂 |
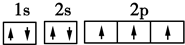 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.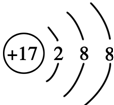 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1,则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ/mol的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定 | |
| D. | 己知C(s)+O2(g)=CO2(g);△H1C(s)+1/2O2(g)=CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀.
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.02mol/(L•s) | ||
| C. | v(C)=0.01mol/(L•s) | D. | v(D)=0.1mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com