
| A、碳酸氢镁溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- |
| B、NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、少量Cl2通入水中:Cl2+H2O?2H++ClO-+Cl- |
| D、酸性高锰酸钾可使草酸溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O |


科目:高中化学 来源: 题型:
| 无机酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K值 | 6.2×10-10(K) | 4.2×10-7(K1) 5.6×10-11(K2) |
6.61×10-4(K) |
| A、氟化钠溶液中通入过量CO2 F-+H2O+CO2=HF+HCO3- |
| B、Na2CO3溶液中2C(Na+)=C(CO32-)+C(HCO3-)+C(H2CO3) |
| C、中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者 |
| D、等浓度的NaCN和NaF溶液中PH值前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| 催化剂 |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A在周期表中的位置为第2周期ⅥA族 |
| B、元素A、B、C的原子半径由大到小的顺序为r(C)>r(B)>r(A) |
| C、A、B两种元素的氢化物的稳定性A>B |
| D、1mol C2B2与足量的AB2完全反应转移约6.02×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
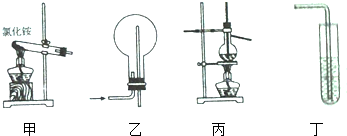
| A、实验室用装置甲制氨气 |
| B、装置乙可用于收集O2、CO2、NO2等气体 |
| C、装置丙可用于分离沸点相差较大的互溶液体混合物 |
| D、装置丁中上层为苯,下层为水,可用于吸收氨气,并能防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) |
| B、c(H2C2O4)>c(C2O42-) |
| C、c(H+)+c(Na+)=c(OH-)+c(C2O42-)+c(HC2O4-) |
| D、c(Na+)>c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 | ||
| B、电解法精炼铜时,精铜作阳极,粗铜作阴极 | ||
| C、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | ||
D、CH3COOH溶液加水稀释后,电离程度增大,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com