
分析 (1)Na2SO3属于强碱弱酸盐,亚硫酸根离子水解而使其溶液呈碱性;再结合电荷守恒判断离子浓度大小;
(2)加水稀释氨水,溶液中除了氢离子和水分子外,所有微粒浓度都减小;温度不变,电离平衡常数、水的离子积常数不变;
解答 解:(1)Na2SO3属于强碱弱酸盐,SO32-水解生成HSO3-、OH-而使其溶液呈碱性,水解方程式为:SO32-+H2O?HSO3-+OH-,钠离子不水解,所以c(Na+)最大,水和亚硫酸根离子水解都生成OH-,所以c(OH-)>c(HSO3-),c(H+) 最小,所以该溶液中离子浓度大小顺序是c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:SO32-+H2O?HSO3-+OH-;c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(2)加水稀释氨水,促进一水合氨电离,溶液体积增大程度大于一水合氨增大的电离程度,所以溶液中氢氧根离子浓度减小,一水合氨分子个数及浓度都减小,温度不变,水的离子积常数不变,所以氢离子浓度增大,
a.溶液中氢氧根离子浓度减小;
b.氨水的电离程度增大;
c.水的离子积常数不变;
d.$\frac{c({H}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大;
故答案为:bd;a;c;
点评 本题考查了盐类水解、弱电解质的电离等知识点,根据弱电解质电离特点、盐类水解特点来分析解答,注意稀释氨水时,氨水溶液中氢离子浓度增大,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 氨水中滴入酚酞溶液,溶液变红:NH3•H2O=NH4++OH- | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O=2Fe2++SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

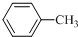 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
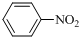 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧气氧化)
(苯胺,易被氧气氧化) .
. .写出③的转化关系
.写出③的转化关系 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$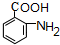 (用已知中的表达方式表示,不用写化学方程式).
(用已知中的表达方式表示,不用写化学方程式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
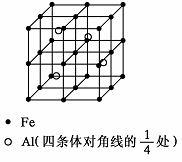 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
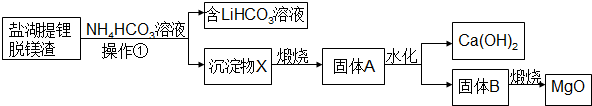
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
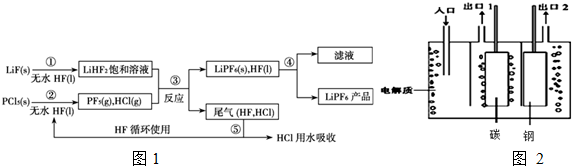
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染 | |
| B. | 农作物收割后留下的秸秆可以就地焚烧 | |
| C. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 汽油发动机工作时会产生少量NO和CO,采用催化反应装置可以减少污染物排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com