
下列反应既属于氧化还原反应,又是吸热反应的是
A.灼热的碳与CO2的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.铝片与稀盐酸的反应 D.甲烷在氧气中的燃烧反应
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是 ( )
A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O===2Fe(OH)2
B.SO2使紫色石蕊溶液变红色:SO2+H2O===2H++SO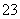
C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-+3H2O===2[Al(OH)4]-
D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+===Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq) Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是
。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b .饱和Na2SO3溶液
c.饱和NaHSO3溶液 d . 饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
。
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2(g) 2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.单位时间内生成n mol O2的同时生成2n mol NO
C.混合气体的密度不再改变的状态
D.混合气体的颜色不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程:
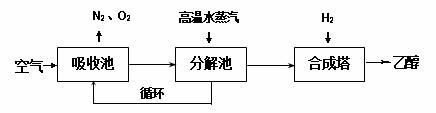
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。回答下列问题:
(1)写出吸收池中反应的离子方程式 。
(2)从分解池中循环使用的物质是 。
|
|
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
提高氢碳n(H2)/n(CO2)比,对生成乙醇 (选填“不利”、“有利”或“无影响”)。
| Q | R | ||
| T | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,浓度都为1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,4s后X2、Y2、Z的浓度分别是0.4mol/L,0.8mol/L,0.4mol/L,如Z用X、Y表示,则该化学方程式可表示为( )
A.X2+2Y2 ==2XY2 B.2X2+Y2 ==X2Y C.3X2+Y2 ==2X3Y D.X2+3Y2 ==2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(KJ)是
A.194 B.391 C.526.7 D.658

查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;

②有关有机 物的沸点见下表:
物的沸点见下表:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用为______________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式__________ _________________________________________________________________。
(2)球形干燥管C的作用是__________________________________________
_________________________________________________________________。
若反应前D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是__________________________________________________________________
_________________________________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________;然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com