
| A. | 它是副族元素 | |
| B. | 它是第七周期元素 | |
| C. | 它的原子核内有97个质子 | |
| D. | 它的一种同位素的核内有108个中子 |
分析 核外电子数=质子数,利用质子数减各周期容纳的元素种数确定在周期表中的位置,元素的相对原子质量根据同位素的相对原子质量计算所得的平均值,不等于质量数,不能确定其中一种同位素的质量数.
解答 解:原子核外的电子数为97,故原子核内质子数为97,原子核外有七个电子层,最外层为2个电子,位于周期表中第七周期,第ⅢB的锕系元素,元素的相对原子质量根据同位素的相对原子质量计算所得的平均值,不等于质量数,不能确定其中一种同位素的质量数,不能确定其中一种同位素的中子数,故ABC正确,D错误,
故选D.
点评 本题考查结构位置性质关系、元素周期表、相对分子质量等,难度不大,确定元素在周期表中的位置是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中通入过里Cl2:2Fe++2Br-+2Cl2=2Fe+Br2+4Cl- | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | NaHSO4溶液中滴加Ba(OH)2溶液至中性:H++OH-+SO42-+Ba2+=BaSO4↓+H2O | |
| D. | NaHCO3溶液与NaAlO2溶液反应:HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 是否能形成丁达尔效应是胶体和溶液最本质的区别 | |
| B. | 胶体具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 | |
| C. | 纳米材料粒子直径一般从几纳米到几十纳米(1 nm=10-9 m),因此纳米材料属于胶体 | |
| D. | 除去Fe(OH)3胶体中的FeCl3,可将混合物装入半透膜中,放入蒸馏水里 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 氢氧燃料电池不属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗的原子序数为24 | B. | 锗的金属活动性应比硅强 | ||
| C. | Ge可以生成化学式为Na2GeO3的盐 | D. | 单质锗是半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢是白色有刺激性气味的气体 | |
| B. | 氯化氢具有强酸性 | |
| C. | 氯化氢能使干燥的蓝色石蕊试纸变红 | |
| D. | 氯化氢极易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
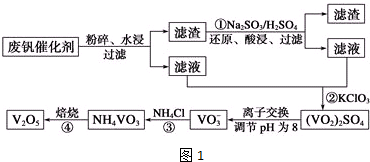
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
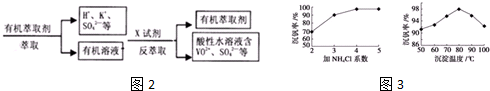
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com