
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的O2和O3含有的原子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁分别与足量氯气和硫完全反应时转移的电子数 |
分析 A.H和D原子的中子数不同;
B.原子摩尔质量相等,氧气和臭氧质量相等,其原子个数相等;
C.一氧化碳和NO含有的质子数不同;
D.Fe被氯气氧化为+3价,而被S氧化为+2价.
解答 解:A.物质的量相等的H2O与D2O含有的中子数比值为(8):(8+2×1)=8:10,中子数不同,故A错误;
B.O2和O3的组成元素相同,原子摩尔质量相等,氧气和臭氧质量相等,其O原子个数相等,故B正确;
C.CO的质子数为6+8=14,而NO的质子数为7+8=15,同温、同压、同体积的一氧化碳和一氧化碳含有的质子数不相等,故C错误;
D.Fe被氯气氧化为+3价,而被S氧化为+2价,则等物质的量的铁分别与足量氯气和硫完全反应时转移的电子数一定不等,故D错误.
故选B.
点评 本题考查了物质的量的计算和阿伏加德罗常数,题目难度不大,侧重于考查学生的分析能力和计算能力.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:实验题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为92 | B. | 质子数为92 | C. | 电子数为92 | D. | 中子数为92 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离酒精和水的混合物 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 装置②中若装满水,收集H2的时候应该从a口通入H2 | |
| D. | 装置①用CCl4萃取碘水中的碘时,CCl4层在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
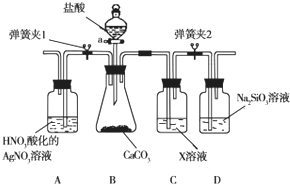 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
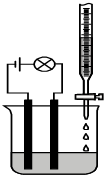 某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:
某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:| Ba(OH)2(ml) | 溶液中的总离子浓度(mol/L) |
| 0.0 | 0.30 |
| 5.0 | 0.10 |
| 10.0 | ≈0.00 |
| 15.0 | 0.06 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| B. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com