
下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构图的是 ( )。
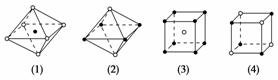
A.图(1)和图(3) B.图(2)和图(3)
C.图(1)和图(4) D.只有图(4)
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
右图为雾霾的主要成分示意图。下列说法不正确的是
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.SO2和NxOy都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法合理的是
A.若X+ 和Y2 - 的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCI>H2S,可推断出元素的非金属性:CI>S
C.邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键
D.H—F、H—O、H—N三种共价键的极性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 B、C、D、E五种短周期元素,元素A最外层电子数与其周期数相等,A与C可形成A2C2和A2C两种化合物,B的最高价氧化物对应的水化物与气体BA3化合生成乙,D+与C2-具有相同的电子数,E元素最高化合价与最低化合价代数和为6。
请回答下列问题:
(1) C在元素周期表中的位置为____________。写出BA3的电子式_______________。
(2)上述元素中,原子半径最大的是____________________(写元素符号)。最高价氧化物对应的水化物中酸性最强的酸是__________________(写化学式)。
(3)化合物乙的水溶液呈酸性,请用离子方程式表示__________________。
(4) A、C、E三种元素按原子个数比1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒的个数比不是1∶1的是 ( )。
A.NaHCO3晶体中阴、阳离子
B.NH3分子中的质子和电子
C.Na2O2固体中阴、阳离子
D.12H原子中的质子和中子
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应不同的元素。
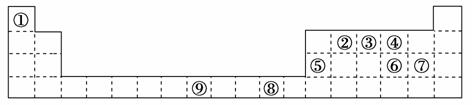
请回答下列问题:
(1)表中属于d区的元素是________(填编号);元素⑧的原子价电子排布式是____________。
(2)③和⑦形成的常见化合物的晶体类型是________;②③④的电负性:________>________>________(用元素符号表示)。判断依据是_________________________________________________________________。
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的________(填编号);该元素与元素①形成的化合物X极易溶于水的原因是__________________________________________________________________
_________________________________________________________________。
(4)②③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为________,其熔点比金刚石的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知乙烯分子是平面结构,因此1,2二氯乙烯可形成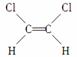 和
和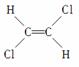 两种不同的空间异构体,称为顺反异构。下列能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,称为顺反异构。下列能形成类似上述两种空间异构体的是( )
A.1丁烯 B.2甲基1丙烯 C.2丁烯 D.1丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
 Cr2O
Cr2O
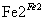 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com