
| A����ˮ���Ȼ�淋Ļ��Һ����pH=7ʱ��c��Cl-����c��NH4+�� |
| B��pH=2��һԪ���pH=12��NaOH��Һ�������ϣ����Һ��c��H+����һ������c��OH-�� |
| C��0.1mol/L��Na2CO3��Һ�У�c��Na+��=c��H2CO3��+c��HCO3-��+2c��CO32-�� |
| D��PH=3��H2SO4��NaCl��Һ�У�һ������c��Na+��=c��Cl-�� |


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
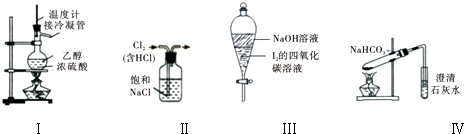
| A����װ�â���ʵ�����Ʊ�������ϩ |
| B����װ�â�����ȥ�����к��е�HCl���� |
| C��װ�â��У�������ã��²���Һ��ɫ���ֲ��� |
| D����װ�â���̽��NaHCO3�����ȶ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��4.8 g |
| B��8.8 g |
| C��9.6g |
| D��14.4g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʣ�����������ͭ����� |
| B��ԭ����������ͭ��������9.6g |
| C����Ӧ����Һ��n��Fe3+��=0.10 mol |
| D����Ӧ����Һ��n��Fe2+��+n��Cu2+��=0.75 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.2mol?L-1HF��Һ��0.1mol?L-1NaOH��Һ�������ϣ�2c��H+��-2c��OH-��=c��F-��-c��HF�� |
| B��0.1mol?L-1KHCO3��Һ�У�c��CO32-��+c��OH-��=c��H+��+2c��H2CO3�� |
| C��pH=11�İ�ˮ��pH=3������������ϣ�c��Cl-��=c��NH+����c��OH-��=c��H+�� |
| D��������ˮ�м������NaOH��c��Na+��=c��Cl-��+c��ClO-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��a=b | B��a��b |
| C��a+b=14 | D��a��14-b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������� | B������ |
| C����������Һ | D���Ȼ�������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ˮ�ĵ��������ȹ��� |
| B���κ��кͷ�Ӧ���Ƿ��ȷ�Ӧ |
| C����ⱥ��ʳ��ˮʱ������ת��ɻ�ѧ�� |
| D����2H2��g��+O2��g��?2H2O��g����H=-483.6kj?mol-1����֪��ȼ����Ϊ241.8kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K+��SO42-��Cu2+��NO3- |
| B��Fe3+��Na+��I-��HCO3- |
| C��Mg2+��H+��SiO32-��SO42- |
| D��K+��NH4+��OH-��SO42- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com