合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)
ad
ad
.
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=
.
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越
小
小
(3)某温度下,若把10mol N
2与30mol H
2 置于体积为10L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=
(可用分数表示).能说明该反应达到化学平衡状态的是
bd
bd
(填字母).
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ
正(N
2)=2υ
逆(NH
3) d.混合气体中 c(NH
3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)
ac
ac
.
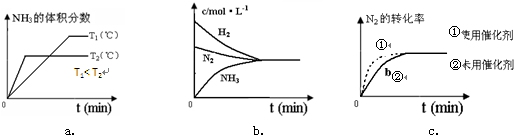
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N
2和3molH
2,此时两容器的体积相等.在一定条件下反应达到平衡状态,A中NH
3的体积分数为a,放出热量Q
1kJ;B中NH
3的体积分数为b,放出热量Q
2kJ.则:
a
<
<
b(填>、=、<),Q
1<
<
Q
2(填>、=、<),Q
1<
<
92.4(填>、=、<).

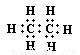 B、乙烯的结构式:
B、乙烯的结构式: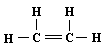
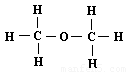 D、乙酸的结构简式:CH3COOH
D、乙酸的结构简式:CH3COOH 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)