
科目:高中化学 来源: 题型:选择题
| A. | NaOH、Na2SO4、NaCl | B. | NaCl、Na2SO4、NaOH | ||
| C. | NaOH、NaCl、Na2SO4 | D. | Na2SO4、NaOH、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
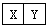 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族.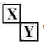 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.4d mol•L-1 | B. | 12.7d mol•L-1 | C. | 6.97d mol•L-1 | D. | 6.35d mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 在氢氧化钡溶液中逐滴加入硫酸氢钠溶液至恰好呈中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H-+H2O2═Fe3++2H2O | |
| D. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 1 mol该烃含有4 mol碳碳双键 | |
| C. | 能发生聚合反应,其产物可表示为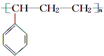 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓磷酸与浓硫酸的性质相似 | |
| B. | 浓磷酸与浓硫酸一样难挥发,且属非氧化性酸 | |
| C. | 浓磷酸无氧化性,只有还原性 | |
| D. | 浓磷酸的酸性强于氢溴酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com