
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是
A.HF、HCl、HBr、HI的热稳定依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr、NaI的熔点依次减小
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2 价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
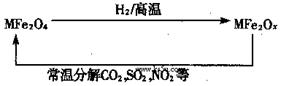
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
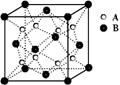
某离子晶体中晶体结构最小的重复单元如图:A为阴离子,
在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为
A.BA2 B.B2A C.B7A4 D.B4A7
查看答案和解析>>
科目:高中化学 来源: 题型:
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
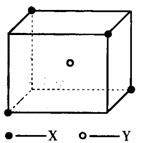 (1)晶体中每个Y同时吸引着__________个X,每个x同时
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹∠XYX的
度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将22.4 L HCl完全溶于1 L水中(水的密度近似为1 g/mL),溶液的密度为ρ g/cm3,溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w= ×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
×100% ②c=1 mol·L-1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w ④所得溶液中含有NA个HCl分子
A.全部 B.①③④ C.①③ D.只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
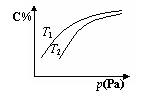
在密闭容器中,对于可逆反应A +3B  2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
A.若正反应方向△H <0,则T1> T 2
B.压强增大时,混合气体的平均相对分子质量减小
C.A一定为气体
D.B一定为气体
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com