
| A. | 露置在空气中,容器内酸液的质量都减轻 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 常温下都能与氨气反应 | |
| D. | 加热条件下都能与碳反应 |
分析 A.浓硫酸具有吸水性、浓硝酸具有挥发性;
B.加热条件下,铜和浓硫酸能发生氧化还原反应;
C.常温下,氨气与硫酸反应生成硫酸铵,氨气与硝酸反应生成硝酸铵;
D.加热条件下,二者都能与碳发生氧化还原反应;
解答 解:A.浓硫酸具有吸水性,能吸收空气中的水蒸气,质量增加,浓硝酸具有挥发性,质量减轻,故A错误;
B.加热条件下,铜和浓硫酸发生氧化还原反应生成二氧化硫,常温下,铜和浓硝酸反应生成二氧化氮,故B错误;
C.常温下,氨气与硫酸反应生成硫酸铵,氨气与硝酸反应生成硝酸铵,所以两者都反应,故C正确;
D.加热条件下,浓硫酸和浓硝酸都与碳发生氧化还原反应生成气体氧化物和水,故D正确;
故选CD.
点评 本题考查了浓硫酸、浓硝酸的性质,根据浓硫酸和浓硝酸的强氧化性、与铁的钝化等知识点来分析解答即可,比较容易.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 通入HCl | ||
| C. | 加入适量的NaOH(固体) | D. | 加入固体NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
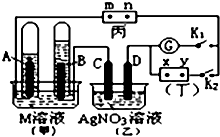 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为v(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 三个溶液中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置或操作 |  | 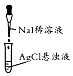 | 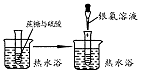 | 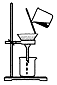 |
| 实验目的 | 配制一定物质的量浓度的稀硫酸 | 悬浊液由白色转为黄色证明Ksp(AgCl)大于Ksp(AgI) | 验证蔗糖在硫酸催化作用下发生水解反应 | 从碳酸氢钠悬浊液中分离出NaHCO3的晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
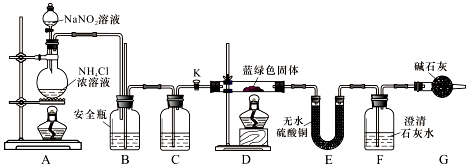
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准况状下,44.8 L四氯筑化碳含有的分子数为2NA | |
| B. | 0.1mol/L氯化铝溶液中含有Al3+数为0.1 NA | |
| C. | 1.8 g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com