
分析 (1)相对分子质量等于化学式中各原子相对原子质量之和,摩尔质量以g/mol为单位,数值上等于其相对分子质量,根据n=$\frac{m}{M}$计算H2物质的量,根据V=nVm计算H2体积,根据N=nNA计算H2分子数目,每个H2分子含有2个氢原子,含有氢原子数目为H2分子的2倍;
(2)根据稀释定律c1v1=c2V2计算浓盐酸的体积;
(3)设CO和CO2的物质的量分别为x、y,则列方程组$\left\{\begin{array}{l}{28x+44y=21.6}\\{x+y=\frac{13.44L}{22.4L/mol}}\end{array}\right.$计算CO和CO2物质的量,进而可计算混合气体的平均摩尔质量.
解答 解:(1)H2的相对分子质量为2,故其摩尔质量为2g/mol,4gH2的物质的量为:$\frac{4g}{2g/mol}$=2mol,其标准状况下的体积为:2mol×22.4L/mol=44.8L,其含H2分子的个数为2mol×6.02×1023mol-1=1.204×1024,含有氢原子的个数为:1.204×1024×2=2.408×1024,
故答案为:2g/mol;2;44.8L;1.204×1024;2.408×1024;
(2)欲用12mol•L-1浓盐酸和蒸馏水配制500mL物质的量浓度为0.60mol/L的稀盐酸,配制过程中HCl的物质的量不变,则需要浓盐酸的体积为:$\frac{0.6mol/L×0.5L}{12mol/L}$=0.025L=25mL,
故答案为:25;
(3)设CO和CO2的物质的量分别为x、y,则列方程组$\left\{\begin{array}{l}{28x+44y=21.6}\\{x+y=\frac{13.44L}{22.4L/mol}}\end{array}\right.$,解得:x=0.3mol、y=0.3mol,气体共为0.6mol,该混合气体的平均摩尔质量为:$\frac{21.6g}{0.6mol}$=36g/mol,
故答案为:36g/mol;0.3.
点评 本题考查物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,试题计算量较大,充分考查了学生的分析能力及化学计算能力.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次减弱 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| D. | 熔融状态能导电的化合物一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
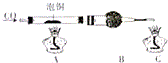
 厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子).下列说法正确的是( )| A. | 通电后,阳极附近pH增大 | |
| B. | 电子从负极经电解质溶液回到正极 | |
| C. | 通电后,A-通过阴离子交换膜从阴极进入浓缩室 | |
| D. | 当电路中通过2mol电子的电量时,会有1mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
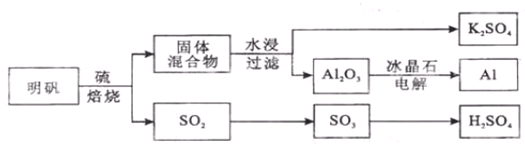
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
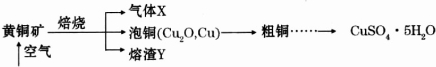
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此将胶体与溶液、悬浊液区分开来 | |
| C. | 光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 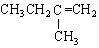 2-甲基丁烯 2-甲基丁烯 | D. | 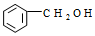 苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d1=d2 | B. | d1>d2 | C. | d1<d2 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com