
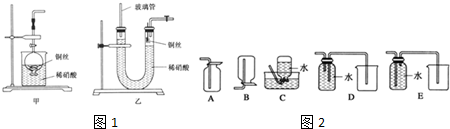
分析 I.(1)Cu与硝酸反应生成硝酸铜、NO和水,以此书写离子反应;
(2)①根据试验的目的是证明金属铜和硝酸之间的反应,根据目的选择所用的材料;
②图1中试管内有空气,NO被氧化为红棕色的气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据一氧化氮的溶解性与氧气的反应确定收集方法;
(5)根据得失电子守恒解答,1个铜原子失去2个电子,1个氧分子得到4个电子变成-2价的氧;
II.从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染.
解答 解:I.(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,
故答案为:C、D;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2;
(3)①一氧化氮是难溶于水的气体,当取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,
故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止,则应该使铜和稀硝酸分开,具体操作方法及原因是关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,
故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)由于一氧化氮与氧气在常温下反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E排水法收集装置,应该短进长出,所以D正确,E错误,故选:CD;
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2240mL,
故答案为:2240mL;
II.甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,故甲不正确;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,故乙不正确;
丙:此过程中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故丙不正确;
丁:此过程用方程式可表示为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,故丁正确;
故答案为:丁;制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体;
点评 本题考查了铜与硝酸的反应,掌握相关的化学反应方程式是解答本题的关键,注意NO易被氧化及NO对环境的污染,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
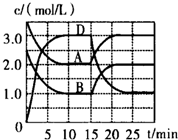 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
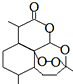 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com