
| A. | CH3CH2Cl | B. | CO2 | C. | Cl2 | D. | NaNO3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
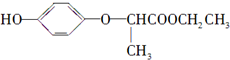 下列有关HPE的说法正确的是( )
下列有关HPE的说法正确的是( )| A. | 1 mol HPE最多可和2 mol NaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | HPE不能发生加成反应 | |
| D. | HPE在核磁共振氢谱中有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气体一定处于标准状况 | |
| D. | 在标准状况下,1gH2和11.2LO2的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | c(NH4Cl)/mol.L-1 | 温度/℃ | 待测物理量 | 实验目的 |
| Ⅰ | 0.5 | 30 | x | - |
| Ⅱ | 1.5 | i | y | 探究浓度对氯化铵水解平衡的影响 |
| Ⅲ | 0.5 | 35 | z | ii |
| Ⅳ | 2.0 | 40 | m | 探究温度、浓度同时对氯化铵水解平衡的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
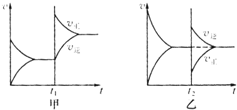 在一定条件下,有反应xA+yB?zC.
在一定条件下,有反应xA+yB?zC.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 10 | 20 | 30 | 40 | 50 | 60 |
| n(CH3OH)/mol | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol丙烷共用电子对数为6NA | |
| B. | 1mol甲醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 0.1mol甲烷和0.1mol乙酸完全燃烧消耗的O2分子数都为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com