
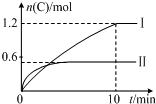
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
分析 A.根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 aKJ
变化量(mol) 0.6 0.6 1.2 0.6 96KJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化;
B.结合A中化学平衡三段式列式计算平衡浓度,c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
C.图象分析可知实验Ⅰ中,10 min内C生成了1.2mol,结合化学反应速率V=$\frac{△c}{△t}$计算,速率之比等于化学方程式计量数之比,以此计算B的反应速率;
D.根据等效平衡分析判断,反应前后气体体积不变,等比等效分析.
解答 解:A.由化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 aKJ
变化量(mol) 0.6 0.6 1.2 0.6 96KJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化,则a=$\frac{96kJ}{0.6mol}$=160KJ/mol
图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以a=-160KJ/mol,故A正确;
B.由A中可知平衡浓度:c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数K=$\frac{0.{6}^{2}}{0.2×1.2}$=1.5,故B错误;
C.10 min内C生成了1.2mol,则反应速率V(C)=$\frac{\frac{1.2mol}{2L}}{10min}$=0.06mol/L•min,速率之比等于化学方程式计量数之比,V(B)=$\frac{1}{2}$V(C)=0.06mol/L•min×$\frac{1}{2}$=0.03mol/L•min,故C错误;
D.反应前后气体体积不变,等比等效,开始投入量 AB之比为3:1,向实验Ⅱ的平衡体系中再充1.5 mol A和0.5 mol B,可以看作先投入0.5 mol A和1.5 mol B后再投入0.5 mol A和1.5 mol B,两个平衡为等效平衡,则A的转化率不变,故D正确.
故选AD.
点评 本题考查化学平衡计算,涉及图象的理解判断、平衡常数、反应速率、等效平衡的计算与分析应用,明确化学平衡及其影响为解答关键,D为易错点,注意掌握等效平衡的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:推断题

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成蓝色 | Cl2+2I-=I2+2Cl-(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl(用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中通入过量的二氧化碳CO2+OH?═HCO3- | |
| B. | 金属钠和水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 酸性氯化亚铁溶液中加入双氧水2Fe2++H2O2═2Fe3++O2↑+2H+ | |
| D. | 三氧化硫与氯化钡溶液生成沉淀的反应SO3+Ba2++H2O═BaSO4↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
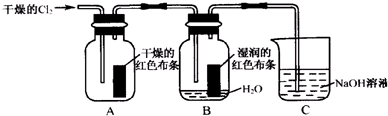
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
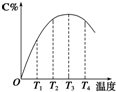 可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂,O2是还原产物 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 由上述方程式可知氧化性:Na2FeO4>Na2O2>O2 | |
| D. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物 | |
| B. | 把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成 | |
| C. | 工业上通常用电解钠、镁、铝对应的熔融氯化物制得该三种金属单质 | |
| D. | 将水蒸气通过灼热的铁粉,反应后固体质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com