
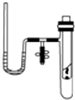
 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.分析 (1)①硫酸铜结合5个结晶水生成无水硫酸铜,据此写出反应的方程式;
②察到U形管右侧的液面立即下降,说明试管中温度升高,该反应为放热反应;
③放热反应中,反应物总能量大于生成物总能量;
(2)氢氧化钡晶体与氯化铵的反应为吸热反应,试管中温度减小,则气体体积减小,据此判断反应现象.
解答 解:(1)①硫酸铜与水反应生成无水硫酸铜,反应方程式为:CuSO4+5H2O=CuSO4•5H2O,
故答案为:CuSO4+5H2O=CuSO4•5H2O;
②把水滴入小试管内,使白色的无水硫酸铜完全变成蓝色的五水硫酸铜晶体,可观察到U形管右侧的液面立即下降,左侧的液面上升,说明试管中温度升高,硫酸铜与水的反应为放热反应,
故答案为:放热;
③该反应为放热反应,则反应中的硫酸铜和水具有的总能量大于硫酸铜晶体的总能量,
故答案为:大于;
(2)如果U形管内两边的液面处于同一水平面后,在小试管内先加入Ba(OH)2•8H2O晶体,再加入NH4Cl固体,用玻璃棒不断搅拌,该反应为吸热反应,则可观察到U形管右侧的液面立即上升,左侧的液面下降,
故答案为:U形管右侧的液面立即上升,左侧的液面下降.
点评 本题考查了探究吸热反应与放热反应,题目难度中等,明确吸热反应、放热反应与能量变化的关系为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | NO | C. | NO2 | D. | NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
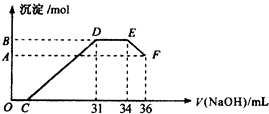 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低(如生成NO、N2O、N2、NH4+等).现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 沸点:CH4>SiH4>GeH4>SnH4 | |
| C. | 熔点由高到低:Al>Mg>Na | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com