
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、标准状况下,2.24L苯中含0.6NA个氢原子 |
| B、22.4LCl2通入水中充分反应,共转移NA个电子 |
| C、1L1mol?L-1氯化铜溶液中Cu2+的数目小于NA |
| D、0.1mol铁在0.1molCl2中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
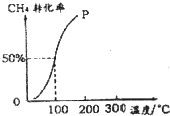 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
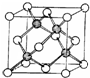 A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;Cn-与D+具有相同的电子层结构; E原子的3d能级中成对电子数与未成对电子数之比为4:3.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X是形成化合物种类最多的元素,它的一种气态氧化物能产生温室效应 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z和Y形成的一种化合物Z2Y2为淡黄色粉末,可作为呼吸面具里氧气的来源 |
| V | V的单质是淡黄色固体,是黑火药的一种主要成分 |
| W | W的单质是人们最早发现和使用的金属之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A、同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 |
| B、结合H+ 的能力:ClO->CO32->F- |
| C、碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑ |
| D、次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O=HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com