
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| (1+n)3 |
| (1-n)3 |
| ||
| 10min |
| 0.6mol |
| 1mol |


科目:高中化学 来源: 题型:
| 溶液中检测出的溶质 | |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、K2CO3、Na2SO4、NaCl |
| 第三次 | KCl、BaCl2、Na2CO3、NaCl |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验① | ② |
| 第二步 | 继续滴加过量的③ | 检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加⑤ | 检验⑥ | Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
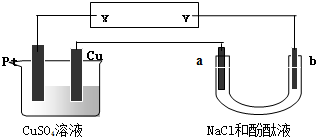
| A、NaCl溶液浓度不变 |
| B、X是负极,Y是正极 |
| C、CuSO4溶液浓度变小 |
| D、X是正极,Y是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
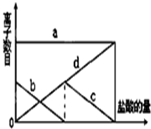 少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A、a:Cl-b:K+ c:CO32- d:HCO3- |
| B、a:K+ b:CO32- c:Cl- d:HCO3- |
| C、a:K+ b:CO32- c:HCO3- d:Cl- |
| D、a:K+b:HCO3- c:Cl- d:CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
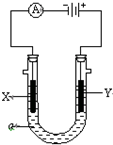 (1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是查看答案和解析>>
科目:高中化学 来源: 题型:
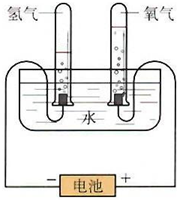 某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.| 质量g | 物质的量mol | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |
| 条件 | 物质 | 1mol物质的体积 |
| 0℃101kPa | H2 | 22.3L |
| O2 | 22.4L | |
| CO2 | 22.4L | |
| 25℃101kPa | H2 | 24.4L |
| O2 | 24.5L | |
| CO2 | 24.5L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com