
分析 发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,铜足量,溶液中n(NO3-)=0.2mol,n(H+)=0.2mol+0.2mol×2=0.6mol,由反应可知,氢离子不足,根据氢离子计算参加反应Cu的物质的量,进而计算转移电子.
解答 解:混合溶液中n(NO3-)=0.1L×2mol/L=0.2mol,n(H+)=0.2mol+0.1L×2mol/L×2=0.6mol,
Cu足量,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知0.2molNO3-完全反应需要0.8molH+离子,大于溶液中0.6molH+离子,故H+离子不足,则参加反应Cu为0.6mol×$\frac{3}{8}$,故转移电子为0.6mol×$\frac{3}{8}$×2=0.45mol,
故答案为:0.45mol.
点评 本题考查化学方程式有关计算,注意酸性条件下,硝酸根具有强氧化性,关键是明确反应本质,利用离子方程式解答,难度中等.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
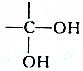 结构的有机物不能稳定存在,根据以上信息,试回答:
结构的有机物不能稳定存在,根据以上信息,试回答: +2H2O,是酯化反应.
+2H2O,是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳气体通入氨水中 | B. | 二氧化硫气体通入澄清石灰水中 | ||
| C. | 五氧化二磷投入碱溶液中 | D. | 二氧化硅投入烧碱溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全球禁用氟里昂是为了保护臭氧层不被破坏 | |
| B. | 误食重金属盐,可用喝牛奶或生鸡蛋清进行解毒 | |
| C. | 苯酚有毒,但它的稀溶液可直接用作防腐剂和消毒剂 | |
| D. | 变质的花生油有难闻的特殊气味,是由于油脂发生了水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
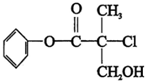
| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A 可与NaOH 溶液反应,生成多种可溶于水的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②③④ | C. | ②③ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com