
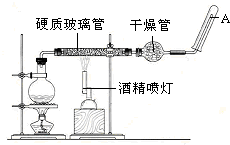
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,就可以完成高温下“Fe与水蒸气的反应实验”.请设计实验,证明还原铁粉与水蒸气能够发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,就可以完成高温下“Fe与水蒸气的反应实验”.请设计实验,证明还原铁粉与水蒸气能够发生反应.分析 (1)生成物是四氧化三铁和氢气,根据化合价的变化判断;
(2)实验前必须对整套装置进行气密性检查;
(3)证明铁和水蒸气反应的方法可以根据固体的性质验证分析,也可以依据生成的气体为氢气;
(4)在滤液中加硫氰化钾溶液,根据现象判断是否存在Fe3+.
解答 解:(1)铁与水蒸气发生氧化还原反应:3Fe+4H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,反应中Fe的化合价升高,则Fe为还原剂,水中氢的化合价降低,水作氧化剂;
故答案为:3Fe+4H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;Fe;H2O;
(2)实验前必须对整套装置进行气密性检查,防止实验过程中发生漏气;
故答案为:检验装置的气密性;
(3)证明还原铁粉与水蒸气发生了反应的方法是收集气体进行爆鸣实验,证明铁发生了反应,
故答案为:检验是否有H2产生;
(4)在滤液中加硫氰化钾溶液,若溶液显红色,说明存在Fe3+;
故答案为:滤液中加硫氰化钾溶液,若溶液显红色,说明存在Fe3+.
点评 本题为铁及其化合物的性质实验,题目难度不大,要掌握装置气密性的方法及检验气体纯度的方法,侧重于考查学生的实验探究能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 取少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解 | 溶液中含有Ag+或SO42- |
| B | 取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色 | 溶液中含有Br- |
| C | 取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝 | 溶液中含有NH4+ |
| D | 取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色 | 原溶液中含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 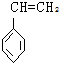 | B. | 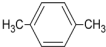 | C. | 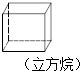 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何钠盐放人水中均不水解 | |
| B. | 可溶性铝盐溶于水都能水解 | |
| C. | NaC1水解后溶液呈中性 | |
| D. | NaHCO3溶液中只存在水解平衡不存在电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
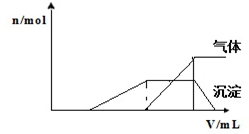 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 | Cl- Br- I?ClO? AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(X-) | 1.25mol | 1.5mol | 2mol |
| n(Y-) | 1.5mol | 1.4mol | 0.9mol |
| n(Z-) | amol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
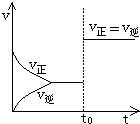 可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )
可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )| A. | 只能通过加入催化剂实现 | B. | 可能通过增大压强来实现 | ||
| C. | 可能通过升高温度实现 | D. | a+b一定不等于c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com