
已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为
A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 B.H2SO4(浓) > Br2 > Fe3+ > Cu2+
C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ D.Cu2+ > Fe3+ > Br2 > H2SO4(浓)
科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.常温常压下,6g H2O中含有的原子数目为NA
B.标准状况下,22.4LCO2含有的分子数目为NA
C.1L1mol·L-1K2SO4溶液中含有的钾离子数目为NA
D.常温常压下,11.2 L氯气与足量铜粉充分反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
巴豆酸是一种对胃肠道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3—CH=CH—COOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④乙醇 ⑤酸性高锰酸钾溶液
试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是
A.只有②④⑤ B.只有①③④ C.只有①②③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
2014年“六·五”世界环境日中国主题为“向污染宣战”,旨在体现对治理污染紧迫性和艰巨性的清醒认识,倡导共同行动,努力改善环境,保卫家园。下列说法正确的是
A.把硝酸工厂的烟囱建造得更高一些,以减少氮氧化物的排放
B.推广燃煤发电,停建核电站,以防核泄漏事故发生
C.将废电池深埋,可以避免其中的重金属污染
D.大量燃烧化石燃料产生的PM2.5是雾霾天气的主要原因之一
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.常温常压下,80 g SO3含有的氧原子数为3NA
C.标准状况下,22?4 L H2中所含原子数为NA
D.一定条件下,56g铁粉与足量的Cl2完全反应转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
下列表述正确的是
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生 ②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长 ③氧化镁可用来制造耐火砖和坩埚等④明矾能使水中的悬浮物凝聚,可做为净水剂 ⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 ⑥给机动车安装尾气净化器,可减少光化学烟雾的发生
A.①④⑤ B.①②④⑤ C.②③④⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是
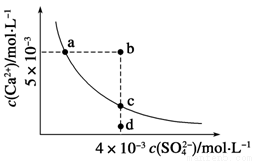
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO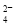 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:实验题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
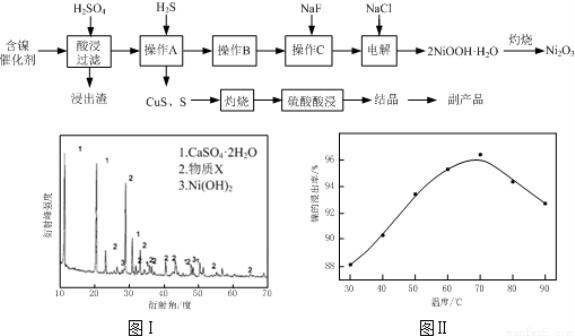
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:填空题
[物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。

(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com