
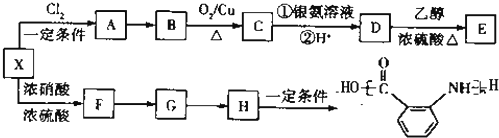
 ,则H是
,则H是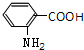 ,结合转化关系可知,X为
,结合转化关系可知,X为 ,F为
,F为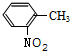 ,G为
,G为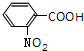 .B的相对分子质量为108,B能被氧化生成C,C能被氧化生成D,则B中含有醇羟基,所以A为
.B的相对分子质量为108,B能被氧化生成C,C能被氧化生成D,则B中含有醇羟基,所以A为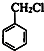 ,B为
,B为 ,B的相对分子质量为108,则C为
,B的相对分子质量为108,则C为 ,D为
,D为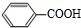 ,E为
,E为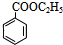 ,据此解答.
,据此解答. ,则H是
,则H是 ,结合转化关系可知,X为
,结合转化关系可知,X为 ,F为
,F为 ,G为
,G为 .B的相对分子质量为108,B能被氧化生成C,C能被氧化生成D,则B中含有醇羟基,所以A为
.B的相对分子质量为108,B能被氧化生成C,C能被氧化生成D,则B中含有醇羟基,所以A为 ,B为
,B为 ,B的相对分子质量为108,则C为
,B的相对分子质量为108,则C为 ,D为
,D为 ,E为
,E为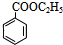 ,
, ,G为
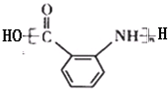
,G为 ,含有的官能团是:羧基、硝基,故答案为:
,含有的官能团是:羧基、硝基,故答案为: ;羧基、硝基;
;羧基、硝基; ,G→H中硝基转化氨基,属于还原反应,故答案为:取代反应;还原反应;
,G→H中硝基转化氨基,属于还原反应,故答案为:取代反应;还原反应; ,
, )发生酯化反应,故c正确;
)发生酯化反应,故c正确; +C2H5OH
+C2H5OH| 浓硫酸 |
| △ |
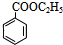 +H2O,
+H2O, +C2H5OH
+C2H5OH| 浓硫酸 |
| △ |
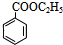 +H2O.
+H2O.


科目:高中化学 来源: 题型:

| A、该硫酸的物质的量浓度为9.2mol?L-1 |
| B、1 mol Zn与足量的该硫酸反应生成2g氢气 |
| C、该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol?L-1 |
| D、向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有大量AlO2-的溶液中:NH4+、Na+、Cl-、H+ |
| B、在pH=12的溶液中:NH4+、K+、ClO-、Cl- |
| C、有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| D、在碳酸氢钠的溶液中:K+、SO42-、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |
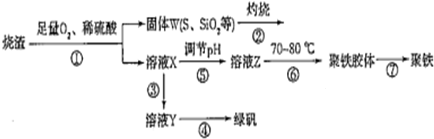
| ||
| 3-n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
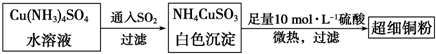
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.05×10-4mol?L-1 |
| B、5.56×10-3mol?L-1 |
| C、1.01×10-4mol?L-1 |
| D、1.01×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com