
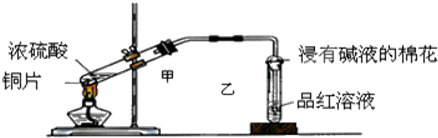
���� ��1�������������Ư���ԣ�ͨ����Ʒ����Һ���������������ͭ��Һ��ʾ��ɫ���ݴ˿��ж��Ƿ�����������ͭ��ͭ��Ũ�����ڼ��������·�Ӧ��������ͭ�����������ˮ��
��2�����������ж������������ܹ���̼������Һ��Ӧ�������Ķ������������̼������Һ���գ�
��3��֤������ʣ�࣬��Ҫ֤����Ӧ�����Һ�д��ڴ���������
��4�����������Ư����������һ�ֲ��ȶ�����ɫ���ʣ�Ϊ��ʱ�ģ����Ⱥ��ָ���
��� �⣺��1��Ũ�����ͭ�ڼ��ȵ���������������ͭ�����������ˮ�����ڶ����������Ư���ԣ���ʹ��Ʒ����Һ��ɫ���ʳ���Ʒ����Һ��֤��������Ĵ��ڣ���Ʒ����ɫ����֤���ж����������ɣ�������Һ�����ɫ��֤��������ͭ���ɣ�ͭ��Ũ���ᷴӦ��ͭ���л�ԭ�ԣ�Ũ�������ǿ�����ԣ���Ӧ������Ȳ��ܷ�������д��ѧ����ʽʱע�⡰Ũ���֣���Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+2H2O+SO2����
�ʴ�Ϊ������Ʒ����Һ��ɫ��������Һ����ɫ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+2H2O+SO2����
��2������������һ���ж����壬���������ܹ���̼������Һ��Ӧ������װ���ҵ��Թܿڲ�����һ�Ž��б���̼������Һ�������������ն���Ķ�������ֹ��Ⱦ������
�ʴ�Ϊ��β�����գ���ֹ����������Ⱦ������
��3��֤����Ӧ��������ʣ�࣬��Ҫ֤����Ӧ�����Һ�д��ڴ��������ӣ����ݽ����˳�����֪���ܺ������ӷ�Ӧ�������������ӷ�Ӧ��ϡ������BaC12��Һ��Ӧ�������ᱵ�����Dz���֤���Ƿ��������ӣ��뱥��NaHSO3��Һ��Ӧ���ɶ�������֤����Һ�к��������ӣ�����AD��ȷ��
�ʴ�Ϊ��AD��
��4�����������Ư��ԭ��Ϊ��������������ɫ����������һ�ֲ��ȶ�����ɫ���ʣ����Ⱥ����ɵ���ɫ���ʷֽ⣬�ָֻ�ԭ������ɫ������ȡ�������Թ�����Һ���Թ��м��ȣ���Һ������ɫ��ɺ�ɫ��
�ʴ�Ϊ������ɫ���ɫ����������Ư��ʱ���ɲ��ȶ�����ɫ���ʣ�
���� ���⿼����ͭ��Ũ��������ʣ���Ŀ�Ѷ��еȣ������漰ͭ��Ũ����ķ�Ӧ��������������ʼ����顢����ʵ�鷽������������۵�֪ʶ��ע����ȷ������������ˮ��Ư��ԭ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���������ƣ�Na2S2O5����һ�ֳ��õĿ���������ij�о�С��Խ��������ƽ��������о���
���������ƣ�Na2S2O5����һ�ֳ��õĿ���������ij�о�С��Խ��������ƽ��������о���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ̼��ˮ�����ķ�Ӧ�����ȷ�Ӧ����ͼ��ʾ��̼��ˮ����������Ӧ����CO��H2��;��������״̬��������E�����Իش��������⣺
̼��ˮ�����ķ�Ӧ�����ȷ�Ӧ����ͼ��ʾ��̼��ˮ����������Ӧ����CO��H2��;��������״̬��������E�����Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 | B�� | 2 | C�� | 3 | D�� | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȫ����ȷ | B�� | �������� | C�� | �������� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | A�ij�$\frac{ʼŨ��}{mol•{L}^{-1}}$ | B�ij�$\frac{ʼŨ��}{mol•{L}^{-1}}$ | ����C��$\frac{��ʼ����}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2��10-2 |
| 2 | 2.0 | 1.0 | 2.4��10-2 |
| 3 | 4.0 | 1.0 | 4.9��10-2 |
| 4 | 1.0 | 1.0 | 1.2��10-2 |
| 5 | 1.0 | 2.0 | 4.8��10-2 |
| 6 | 1.0 | 4.0 | 1.9��10-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��A2��=0.8 mol/��L•s�� | B�� | v��A2��=60 mol/��L•min�� | ||
| C�� | v��AB3��=1.0 mol/��L•s�� | D�� | v��B2��=1.2 mol/��L•s�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com