
分析 用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明没有K+;另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3-和还原性的Fe2+;若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32-或SO42-,因为有Fe2+所以没有CO32-,结合溶液中的电荷守恒分析.
解答 解:用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰,则说明没有K+;另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3-和还原性的Fe2+;若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32-或SO42-,因为有Fe2+所以没有CO32-,
(1)由以上分析可知没有K+,故答案为:K+;
(2)加入少量盐酸生成无色气体,是Fe2+与NO3-和H+反应生成NO,其离子方程式:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
故答案为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(3)由以上分析可知,若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32-或SO42-,因为有Fe2+所以没有CO32-,则步骤③中的白色沉淀为BaSO4,故答案为:BaSO4;
(4)已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子Cu2+或Al3+,若有Cu2+,阳离子的电荷多还须有Cl-,若有Al3+,阴离子加上Cl-,电荷仍不守恒;所以根据电荷守恒可知还有Cu2+、Cl-,所以原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42-,
故答案为:Cu2+、Fe2+、Cl-、NO3-、SO42-.
点评 本题考查了离子检验的实验方法和反应现象分析,为高频考点,侧重于学生的分析能力和实验能力的考查,掌握离子性质和溶液中电荷守恒计算判断存在的离子是解题关键,题目难度较大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | ||
| B | 乙酸乙酯(乙酸) | ||
| C | 乙醇(水) |
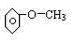 .
.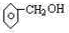 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
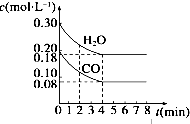 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H>0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30 mol CO、0.10 mol H2O、0.20 mol CO2和20mol H2,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.反应时释放大量热并快速产生大量气体.已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol.又知:H2O(g )=H2O (l)△H=-44kJ•mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为712kJ.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.反应时释放大量热并快速产生大量气体.已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol.又知:H2O(g )=H2O (l)△H=-44kJ•mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为712kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煅烧黄铁矿(FeS2)制SO2 | B. | 电解熔融氧化铝制金属铝 | ||
| C. | 钠与水反应制烧碱 | D. | 氯气与石灰乳反应制漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③④ | B. | ②③①④ | C. | ④③②① | D. | ②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com